ULRICH BOSCH DOS SANTOS
Die Therapie der Sepsis als schwerste Manifestation einer akuten Infektion bleibt eine wissenschaftliche und klinische Herausforderung. Die Sterblichkeit ist nach wie vor hoch, wobei sich die Patientensterblichkeit deutlich in die Phase nach einem überlebten ersten Sepsis Ereignis verschoben hat.
Eine insbesondere – aber nicht ausschließlich – bei älteren Patienten auftretende protrahierte und klinisch häufig nicht erkannte Immunparalyse im Nachgang der Sepsis begünstigt das Auftreten komplizierend hinzutretender bakterieller, fungaler und viraler Infektionen.1
Die Ursachen dieser Immunparalyse sind vielfältig:2
- Alter (Immunoseneszenz, Inflammaging)
- Präoperative Radio-Chemotherapie
- OP-Trauma, ggf. Rezidivtraumen (z. B. Revisionen, VAC-Wechsel, Inhalationsanästhesie)
- Transfusion(en)
- Quelle der Infektion / Sepsis
- Bakteriämie / Candidämie (und deren Dauer), Uhrzeit der Infektion
- Antibiotikatherapie und Dysbiose
- Katecholamine
- Extrakorporale (Organersatz-)Therapie
- Schlafentzug / künstlicher Schlaf / Propofol
- Parenterale Ernährung
- (Unbekannte) maligne Grund-/Begleiterkrankung
- Präoperativer Zustand, „Frialty“, „Gene“, Ernährung / Adipositas, Geschlecht, Vormedikation etc.
Jüngere Studiendaten zeigen auch, dass insbesonders die Gabe von Antibiotika nicht unkritisch geschehen sollte.3 So können in Tierversuchen durch die Gabe von Breitspektrenantibiotika, sogar Lungenentzündungen mit Pseudomonas aeruginosa. induziert werden. Ursache ist die Störung der mukosalen Immunität durch Unterdrückung der IgA-Produktion auf B-Zellebene.4 In der Akutphase der Sepsis beträgt die Apoptoserate von B- und TZellen bis zu 50%.5 Diese Lymphopenie ist leicht im Differenzialblutbild erkennbar. Kliniker fordern zu Recht therapeutischen Optionen, die diese Immunparalyse überwindet.6
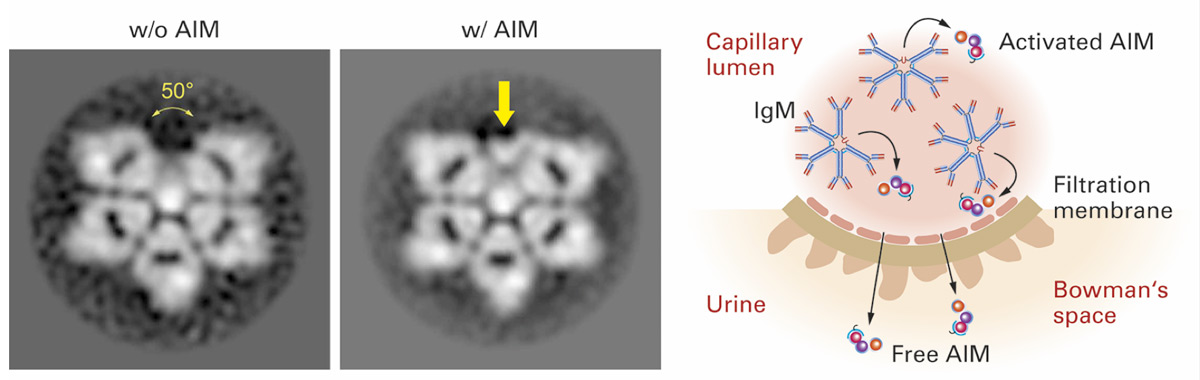
In diesem Zusammenhang kommt der Entdeckung des IgM/AIM*Komplexes – auch IgM/CD5L**-Komplex genannt – eine besondere Bedeutung zu. So gelang es 2018 durch die neue Methode der Kryoelektronenmikroskopie erstmals echte Fotos von IgM Molekülen aufzunehmen (Abb. 1a).7 Diese Fotos zeigen, dass natürliches pentamerisches IgM (80% aller IgM Antikörper) als Carrier eines Proteins AIM bzw. CD5L dient (Abb. 1).7, 8 In der IgM-gebundenen Form ist AIM funktionell inaktiv. Die Aktivierung erfolgt bei der Dissoziation AIM schützt Makrophagen und Immunzellen vor der durch Erreger induzierten Apoptose und reguliert als CD5L viele regulatorische Prozesse der Immunzellen.9
Immunsuppression und Immunstimulation
Durch die Bindung an IgM wird die schnelle renale Eliminierung von AIM (CD5L) verhindert (Abb. 1b), weshalb der AIM-Spiegel im Serum IgM-abhängig ist. In der IgM-gebundenen Form (Serum) ist AIM funktionell inaktiv, die Aktivierung erfolgt bei der Dissoziation von IgM im entzünde ten Gewebe (Abb. 2). So induziert die Gabe des IgM/AIM-Komplexes einerseits die Makrophagenpolarisation zu M2, und induziert so die Interleu kin-10(IL-10) Bildung. Es resultiert also eine Immunsuppression.
Anderseits induziert die Gabe des IgM/AIM-Komplex die Bildung des BZell aktivierenden Faktors (B-cell-activating factor – BAFF)10 was zur Produktion neuer IgA- und IgM-produzierende B-Zellen führt (Abb. 3).11 Es resultiert also eine Immunstimulation.
Dieser Mechanismus erklärt auch die Beobachtung der nachhaltigen Immunglobulinbildung nach Gabe von Penta globin [IgM/AIM (CD5L)] bei (autoimmunerkrankten) septischen Patienten mit Immunglobulin-Defizit.12
Ein IgM/AIM-Komplex wirkt also gleichzeitig immunsuppressiv und immunstimulierend.
Autor: Dr. Ulrich Bosch dos Santos, Senior Medical Liason Manager – Region Central Europe, Intensive Care and Transplantation, Biotest AG, Landsteinerstr. 5, 63303 Dreieich.
__________
*AIM: Apoptosis inhibitor of macrophage
**CD5L: CD5-Ligand
1 Vennet F, Monneret G. Nature Rev Nephrology 2018; 14: 121–137
2 Fischer D, Kindgen-Milles D et al. Anästh Intensivmed 2019; 60: 381–88. DOI: 10.19224/ai2019.381
3 Miller M, Singer M. J Antimicrob Chemother 2022; 77(5): 1218–27. DOI: 10.1093/jac/dkac025
4 Lohmeyer J, Morty RE et al. J Clin Invest 2018; 128(8): 3234–36. DOI: 10.1172/JCI122032
5 Unsinger J, Kazama H et A. J Leukoc Biol 2009; 85(3): 382–90. DOI: 10.1189/jlb.080849
6 Pfortmueller CA, Meisel C et al. Intensive Care Medicine Experimental 2017; 5: 49. DOI: 10.1186/s40635-017-0163-0
7 Keyt BA, Baliga R et al. Antibodies 2020; 9(4): 53. DOI: 10.3390/antib9040053
8 Arai S, Miyazaki T. Seminars in Immunopathology 2018; 40: 567–75. DOI: 10.1007/s00281-018-0717-6
9 Lai X, Xiang Y et al. Int Immunopharmacol 2018; 63: 311–16. DOI: 10.1016/j.intimp.2018.07.022
1 0 Wilson CS, Chhabra P et al. Diabetes 2018; 67(11): 2349–60. DOI: 10.2337/db18-0456
1 1 Mackay F, Browning JL. Nature Reviews Immunology 2002; 2: 465–75. DOI:10.1038/nri844