Zusammenfassung: Die gastroösophageale Refluxkrankheit (GERD) ist häufig. Die Diagnose kann im Einzelfall schwierig sein, da kein diagnostischer Goldstandard existiert. Aus diesem Grund wird zwischen Refluxbeschwerden mit und ohne gesicherte Refluxkrankheit unterschieden. Endoskopie mit Histologie, Impedanz-pH-Metrie und hochauflösende Manometrie kommen situationsabhängig in der Abklärung zum Einsatz und gelten in dieser Kombination als der diagnostische Goldstandard. Allgemeinmaßnahmen wird im Management der Refluxbeschwerden ein hoher Stellenwert zugemessen. Protonenpumpeninhibitoren (PPI) gelten weiterhin als Mittel der ersten Wahl für alle klinischen Manifestationen. Bei genügender Symptomkontrolle aus Patientensicht sind andere Pharmaka aber ebenso akzeptabel. Ausgenommen von dieser Empfehlung sind Patienten mit schwerer Refluxösophagitis (Los Angeles Grad C/D und peptischer Striktur), die a priori eine PPI-Dauertherapie erhalten sollten. Persistierende Refluxbeschwerden unter PPI-Therapie sind häufig. Im ersten Schritt muss die Ursache für das Therapieversagen geklärt werden. Bei PPI-refraktärer Refluxkrankheit kommen pathophysiologisch orientierte Kombinationsbehandlungen und Antireflux-Interventionen zum Einsatz. Eine Antireflux-Operation ist nach entsprechender Abklärung eine Option für Patienten mit schwerer Refluxösophagitis, peptischer Striktur, unzureichendem PPI-Effekt infolge ungenügender Refluxkontrolle und PPI-sensitiver GERD, die eine Dauermedikation nicht wünschen oder die Medikation nicht vertragen.
Schlüsselwörter: Alginat – Antireflux-Operation – gastroösophageale Refluxkrankheit (GERD) – Impedanz-pH-Metrie – Protonenpumpeninhibitoren (PPI)

Prof. Dr. med. Joachim Labenz, Refluxzentrum Siegerland, Diakonie Klinikum
1. Einleitung
Eine gastroösophageale Refluxkrankheit (GERD) liegt vor, wenn Rückfluss von Mageninhalt in die Speiseröhre zu belästigenden Symptomen und/oder Läsionen führt.1 Die GERD ist eine Volkskrankheit mit weiterhin zunehmender Inzidenz und Prävalenz. Jeder zweite Erwachsene kennt Refluxbeschwerden aus eigener Erfahrung und mindestens jeder fünfte ist refluxkrank.2 In der neuen S2k-Leitlinie der DGVS wird den Erkenntnissen der letzten 8 Jahre Rechnung getragen (www.dgvs.de). Manches bleibt – vieles ändert sich.
Die klinische Präsentation ist ausgesprochen variabel. Neben dem typischen Refluxsyndrom (Sodbrennen, saures Aufstoßen, Regurgitation) können andere Symptome wie Oberbauchschmerzen, ischämietypische Thoraxschmerzen (Reflux-Thoraxschmerz-Syndrom), oro-laryngo-pharyngeale Symptome (z. B. Stimmprobleme, Räuspern, Globus, Husten, Schleimfluss, dentale Erosionen), Asthma und Schlafstörungen auftreten.1 Etwa 30% der Patienten entwickelt Schäden im Ösophagus, die von einer endoskopisch sichtbaren Ösophagitis über Stenosen bis hin zum Barrett-Ösophagus bzw. Barrett-Karzinom reichen. Die einzelnen symptomatischen und strukturellen Manifestationen können allein oder in Kombination vorkommen. Zwischen Symptomen und Läsionen gibt es keinen engen Zusammenhang.1–3
II. Diagnostik der GERD
Die Diagnose einer GERD kann im Einzelfall schwierig sein. Dies erklärt sich dadurch, dass das Symptomspektrum breit und unspezifisch ist, jedes einzelne Symptom für sich zudem eine begrenzte Sensitivität und Spezifität aufweist, und auch Läsionen unabhängig von pathologischem Reflux auftreten können. Darüber hinaus gibt es keinen diagnostischen Goldstandard, d. h. es existiert keine Methode, mit der eine GERD in jedem Fall zuverlässig nachgewiesen bzw. ausgeschlossen werden kann.4 Zur definitiven Sicherung der Diagnose einer GERD muss man gemäß der aktuell weiterhin gültigen MONTREAL-Definition nachweisen, dass ein Symptom bzw. eine Läsion durch Reflux von Mageninhalt in die Speiseröhre hervorgerufen wurde.1
1. Symptome
Eine GERD kann asymptomatisch sein. Mit der Schwere der Läsionen nimmt die ösophageale Sensitivität oft ab. Insbesondere Patienten mit Barrett-Metaplasie sind nicht selten symptomfrei.4 Die Symptome Sodbrennen und Regurgitation kommen zwar bei vielen Refluxpatienten vor, insgesamt sind sie aber weder sensitiv (30–76%) noch spezifisch (62–96%).4 Dies ist auch nicht verwunderlich, da viszerale Symptome ganz allgemein weder für auslösende Trigger, Organe oder Lokalisationen spezifisch sind. Auch das Ansprechen auf PPI (PPI-Test) ist diagnostisch nicht wegweisend. Von besonderer klinischer Relevanz ist die konsistente Beobachtung, dass zwischen Schwere und Häufigkeit der Symptome auf der einen Seite und Läsionen in der Speiseröhre auf der anderen Seite keine signifikante Korrelation besteht. Praktisch folgt daraus, dass das Ausmaß der Schädigung in der Speiseröhre nur durch eine Endoskopie festgestellt werden kann. Andere Symptome sind noch wesentlich vieldeutiger, sodass ihnen keine diagnostische Wertigkeit zugemessen werden kann. Stehen extraösophageale Symptome (z. B. unerklärlicher chronischer Husten) im Vordergrund, sollte immer die Frage nach typischen Symptomen wie z. B. Sodbrennen erfolgen, da bei Fehlen typischer Symptome eine Refluxgenese a priori unwahrscheinlich ist.
2. Endoskopie
Die Spiegelung von Ösophagus, Magen und Duodenum (ÖGD) sollte immer dann erfolgen, wenn Alarmsymptome vorliegen (Dysphagie, ungewollter Gewichtsverlust, Blutungszeichen) oder eine familiäre Disposition für Karzinome des oberen Verdauungstrakts vorliegen. Darüber hinaus ist sie indiziert für Männer >50 Jahre mit langjährigen Refluxbeschwerden, Patienten, die nicht auf eine adäquat durchgeführte PPI-Therapie innerhalb von 8 Wochen ansprechen und Patienten mit hohem (täglichen) PPI-Bedarf.5 Als Diagnostikum ist die Methode wenig sensitiv, da nur etwa 30% der GERD-Patienten überhaupt sichtbare Schäden haben.4 Dieser Anteil ist bei laufender PPI-Therapie noch geringer. Die makroskopisch erkennbaren Läsionen („mucosal breaks“) sollen endoskopisch klassifiziert werden. Gebräuchlich ist heute die Beschreibung der longitudinalen und circumferentiellen Ausbreitung der Mukosaläsionen anhand der validierten Los Angeles Klassifikation mit den Schweregraden A–D, wobei aus klinischer Sicht A und B als leichte sowie C und D als schwere Ösophagitis zusammengefasst werden können.5
Der Nachweis einer Hiatushernie belegt nicht das Vorhandensein einer GERD, wenngleich eine Hiatushernie ein prädisponierender pathogenetischer Faktor ist.6 Die endoskopische Diagnostik einer Hiatushernie ist darüber hinaus problematisch, da Nachweis und Ausdehnung bei der Untersuchung variabel sind bzw. sein können. Eine differenziertere Beurteilung der Antireflux-Barriere erfolgt mit der Hill-Klassifikation (Grad IV = Hiatushernie). Sie bildet die über die Zeit progrediente Schädigung der Antireflux-Barriere ab, auch korrelieren die Befunde mit dem Schweregrad der ösophagealen Schädigung.7 Der Durchmesser des Hiatus oesophagei, wie er chirurgisch beschrieben und gemessen werden kann, ist endoskopisch nicht bestimmbar.
3. Histologie
Die Histologie aus makroskopisch unauffälligem Plattenepithel des Ösophagus zeigt zwar oft Veränderungen (elongierte Papillen, verbreiterte Basalzellschicht, dilatierte Interzellularspalten, intraepitheliale Entzündungszellen), die mit einer Refluxschädigung kompatibel sind, allerdings ist der diagnostische Stellenwert bis heute unklar.4, 5 Insbesondere ist auch nicht klar, an welchen Stellen wie viel Biopsien entnommen werden müssen. Plattenepithel kurz oberhalb der Z-Linie entnommen und völlig frei von derartigen Veränderungen spricht gegen einen relevanten pathologischen Reflux.8 Die Histologie wird aber benötigt zum Nachweis einer Barrett-Metaplasie und zum Nachweis bzw. Ausschluss einer wichtigen Differentialdiagnose, der eosinophilen Ösophagitis. Für die letztgenannte Diagnose bedarf es der Entnahme von mindestens 6 Biopsien entlang der Speiseröhre.
4. Refluxmessung
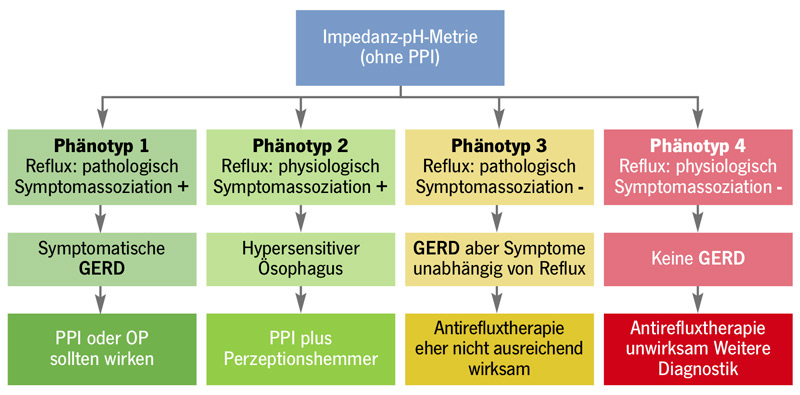
Die Methode der Wahl zum Nachweis von Reflux ist heute die Impedanz-pH-Metrie über 24 Stunden.4, 5 Dabei wird eine Sonde in die Speiseröhre gelegt, die über die Impedanzmessung jegliche Bewegung von Inhalt und auch Luft in der Speiseröhre einschließlich der Richtung und des pH-Werts erfasst. Hiermit kann Reflux exakt quantifiziert und über eine vom Patienten zu betätigende Taste auch den Symptomen zugeordnet werden. Wichtigster Parameter ist die Säureexpositionszeit (AET: acid exposure time) der Speiseröhre, die beim Gesunden unter 4,3% bei Messung über 24 Stunden liegen sollte. Eine Überlegenheit des DeMeester-Scores, der aus verschiedenen Parametern errechnet wird, ist nicht belegt. Anhand dieser Messergebnisse und der Assoziationen zwischen Refluxereignissen und Symptomen lassen sich vier Phänotypen (PT) unterscheiden, die eine Prädiktion potenziell geeigneter Therapieverfahren erlauben (Abb. 1).7 In der letzten Zeit wurden in Studien weitere Parameter wie z. B. die mittlere nächtliche Impedanz (MNBI: mean nocturnal baseline impedance) bei unklarer Befundlage in die Interpretation einbezogen.
Zur Diagnose einer GERD ist eine PPI-Karenz von mindesten 7 besser 14 Tagen vor der Messung erforderlich. Bei im Vorfeld gesicherter GERD und Therapieresistenz sollte die Messung unter der laufenden PPI-Therapie erfolgen. Alternativ kann in besonders gelagerten Fällen eine sondenlose pH-Metrie über bis zu 96 Stunden durchgeführt werden. Das ist insbesondere bei nicht täglich auftretenden Refluxbeschwerden sinnvoll. Mit dieser Methode kann allerdings nur Säurereflux erfasst werden.
5. Hochauflösende Manometrie
Diese Methode trägt zur Diagnose einer GERD nicht richtungsweisend bei, wenngleich GERD-Patienten häufiger Motilitätsstörungen wie z. B. eine Hypomotilität der tubulären Speiseröhre aufweisen. Bei bestimmten Fragestellungen (Differentialdiagnose bei PPI-refraktären Patienten, Evaluation vor interventioneller Therapie) sollte eine hochauflösende Manometrie der Speiseröhre erfolgen. Damit lassen sich der untere Schließmuskel (Lage, Länge, Ruhedruck, schluckreflektorische Erschlaffung) und die Peristaltik im tubulären Ösophagus beurteilen. Ebenso ist der Nachweis / Ausschluss einer Hiatushernie zuverlässig möglich.9
6. Weitere Diagnoseverfahren
Keine Bedeutung für die Diagnosestellung hat der Ösophagusbreischluck.4 Ebenso ist die Messung des sogenannten biliären Refluxes (korrekt: duodeno-gastro-ösophagealer Reflux) mit der Bilitec-Methode ohne diagnostische Relevanz, da sich hieraus keine therapeutische Konsequenz ergibt und leicht- bzw. nicht-saurer Reflux auch über die Impedanz-pH-Metrie heute zuverlässig erfasst wird. Bisher noch nicht genügend validiert sind die Messung der Pepsin-Konzentration im Speichel als einfaches Screening-Verfahren im hausärztlichen Bereich sowie die Messung der mukosalen Impedanz bei der Endoskopie, eine Methode, die die mukosale Integrität widerspiegelt und darüber das Ausmaß der Inflammation in verschiedenen Abschnitten des Ösophagus erfassen und graduieren kann.4
Besonders problematisch ist die Diagnostik bei extraösophagealen Symptomen. Vorweggenommen, ein zuverlässiges Diagnoseverfahren im Hinblick auf Nachweis, Ausschluss und Prädiktion eines Therapieerfolgs gibt es nicht. HNO-ärztlicherseits werden oft Veränderungen im Kehlkopfbereich beschrieben – „Laryngitis gastrica“ – deren Spezifität ausgesprochen gering ist. Dies gilt auch für Scores, die gelegentlich in diesem Bereich eingesetzt werden. Verbreitet ist zudem auch die einfach durchzuführende laryngo-pharyngeale pH-Metrie, mit dem aus pH-Absenkungen im Rachen auf einen gastro-ösophago-pharyngealen Reflux geschlossen wird. Studien haben aber klar gezeigt, dass dieser Rückschluss nicht möglich ist. Bei entsprechender Fragestellung wird man daher dieses Verfahren immer mit einer Impedanz-pH-Metrie kombinieren. Dies erlaubt dann eine Beantwortung der Frage, ob die im Pharynx gemessenen Episoden mit erniedrigtem pH tatsächlich durch Reflux von Mageninhalt bedingt sind.10 Interessant – aber noch nicht abschließend beurteilbar – ist eine digitale Refluxszintigraphie, mit der Reflux aus der Speiseröhre in den Pharynx und die Atemwege visualisiert werden kann.
7. Wann liegt eine GERD vor – der Lyon Konsensus
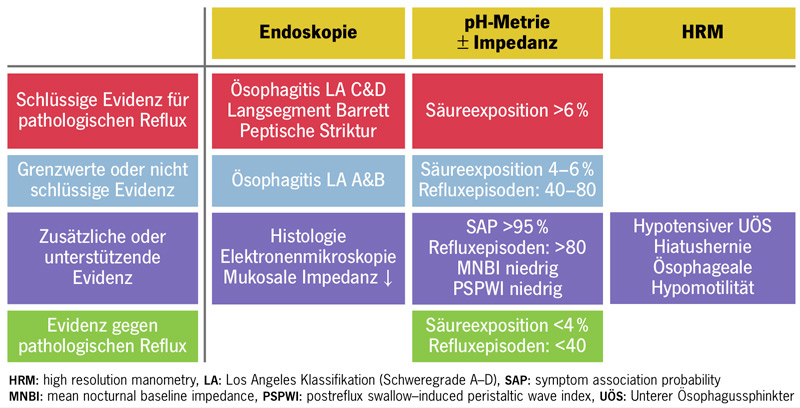
In der klinischen Praxis sollte zwischen Refluxbeschwerden und Refluxkrankheit (= GERD) unterschieden werden, da die Symptome diagnostisch unzuverlässig sind. Es ist durchaus ein pragmatischer Ansatz nicht immer eine Diagnosesicherung anzustreben. Man muss sich dessen nur bewusst sein, wenn es zu Therapieproblemen kommt. Nach dem aktuellen internationalen Lyon Konsens, der auch in der aktualisierten Leitlinie übernommen wurde, sichern vier Befunde für sich allein die Diagnose einer GERD (Abb. 2):
- schwere Refluxösophagitis (Los Angeles Grad C oder D),
- peptische Striktur,
- histologisch gesicherte Barrett-Metaplasie > 1cm,
- Säureexposition der Speiseröhre von > 6% in 24 Stunden.
Eine GERD ist ausgeschlossen bei einer Säureexposition < 4% und weniger als 40 Refluxepisoden pro Tag.9 Hierzu ist anzumerken, dass nicht alle Patienten jeden Tag einen pathologischen Säurereflux haben, sodass bei begründetem Zweifel an einem Normalbefund der Refluxmessung eine prolongierte Untersuchung über 96 Stunden erwogen werden sollte. Viele Patienten werden weder in die eine noch in die andere Kategorie fallen. Hier gilt es in Art eines Puzzles durch Analyse von verschiedenen Komponenten bzw. Befunden die Diagnosewahrscheinlichkeit zu erhöhen. Dies ist insbesondere dann wichtig, wenn aus der Diagnose invasive Konsequenzen gezogen werden sollen.
III. Therapie der GERD
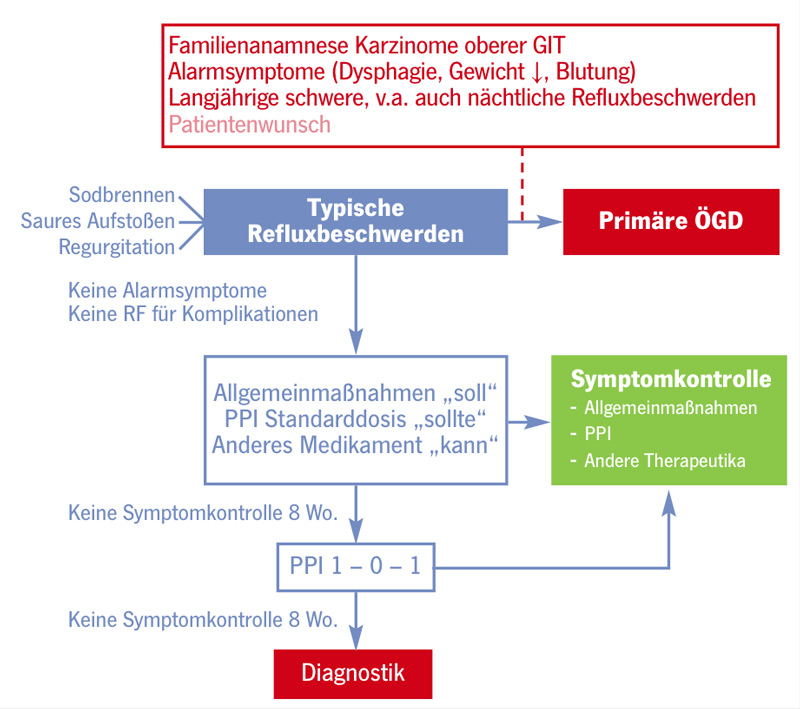
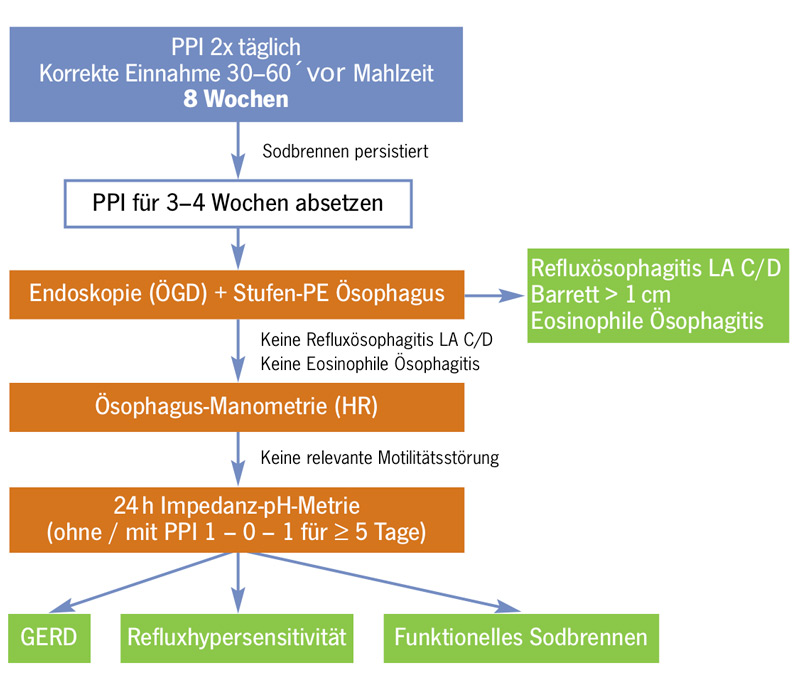
Das wichtigste Ziel der Therapie von Refluxbeschwerden (ohne/mit gesicherter GERD) ist die aus Patientensicht zufrieden stellende Symptomkontrolle. Eine Refluxösophagitis sollte zur Abheilung gebracht werden, wenngleich die Persistenz leichter Veränderungen (Los Angeles A/B) durchaus akzeptabel ist. Eine Prävention von Komplikationen (Striktur, Barrett, Karzinom) ist wünschenswert, kann aber weder medikamentös noch operativ in jedem Fall erreicht werden. In der täglichen Routine ist bei typischem Refluxsyndrom die erste Frage „muss jetzt eine Endoskopie durchgeführt werden?“. Dies ist häufig nicht der Fall. In Abb. 3 findet sich ein leitliniengerechter Algorithmus zum Management von typischen Refluxbeschwerden. Falls keine Endoskopie durchgeführt werden muss, was in >90% der Fälle so sein dürfte, geht es allein um eine zufrieden stellende Symptomkontrolle. Gelingt diese trotz aller Maßnahmen nicht, wird eine weitere Abklärung empfohlen. Zur Behandlung werden Allgemeinmaßnahmen, PPI und auch andere Medikamente empfohlen.
1. Allgemeinmaßnahmen
Am Anfang jeder Therapie soll ein Gespräch über Allgemeinmaßnahmen geführt werden. Von besonderer Wichtigkeit ist eine Gewichtsreduktion (bei Übergewicht). Damit kann oftmals der Verbrauch an Medikamenten gesenkt bzw. das Problem in Einzelfällen sogar ganz gelöst werden.11 Die Art der Ernährung scheint einen Einfluss auf den Säurereflux zu haben, wie eine aktuelle Studie unter Einschluss einer prolongierten pH-Metrie andeutet.12 Ballaststoffe (Obst, Gemüse) und eine Reduktion von Kaffee, Tee und Sprudelwasser haben sich als präventiv erwiesen13 bikarbonatreiches, stilles Mineralwasser (Heilwasser) zeigte in einer randomisierten, doppelblinden Studie eine signifikante Überlegenheit (>20%) hinsichtlich der Kontrolle von Sodbrennen im Vergleich zu einem konventionellen, stillen Mineralwasser.11 Ansonsten gilt, dass unverträgliche Speisen und Getränke gemieden werden sollten. Das Meiden großer und später Mahlzeiten ist logisch, aber nicht evidenzbasiert. Schlafen mit erhöhtem Oberkörper (schiefe Ebene) oder in Linksseitenlage kann vorteilhaft sein. Entsprechende Devices, die eine optimale Schlafposition induzieren sollen, sind in der Entwicklung. Bauchatmung trainiert die Zwerchfellschenkel, die an der Antirefluxbarriere beteiligt sind. Eine genügende Nachtruhe wirkt sich positiv auf die Sensitivität der ösophagealen Schleimhaut aus. Der Verzicht auf Rauchen und die Reduktion eines übermäßigen Alkoholkonsums ist immer gut, die Bedeutung für die Behandlung der GERD aber nicht abschließend gesichert. Medikamente können Reflux fördernd sein oder auch die Ösophagusschleimhaut direkt schädigen. Aus diesem Grund sollte die Komedikation immer sorgfältig geprüft werden.
2. Medikamente
Seit Jahrzehnten gelten Protonenpumpeninhibitoren (PPI) als Mittel der Wahl für alle Patienten mit GERD. Dosis und Dauer der Therapie richten sich nach der klinischen Manifestation.5, 15 PPI haben in zahllosen Studien ihre überlegene Wirksamkeit bei der Behandlung der GERD im Vergleich zu Plazebo, Antazida und H2-Rezeptorantagonisten belegt. Als primäre Studienziele wurden allerdings zumeist die Abheilung einer Refluxösophagitis und/oder die Befreiung vom Leitsymptom Sodbrennen gewählt.
2.1 Wirksamkeit, praktische Durchführung und Sicherheit der PPI-Therapie bei GERD
Die Abheilung einer Refluxösophagitis gelingt mit einem PPI oft.16 Allerdings sind die Heilungsraten einer schweren Refluxösophagitis (Los Angeles Grad C und D) deutlich schlechter. Eine (weitgehende) Elimination von Symptomen gelingt bei weniger als 75% der Patienten.
PPI sollten ca. 30 Minuten vor einer Mahlzeit eingenommen werden. Morgens sind sie wirksamer als abends. Die zweimal tägliche Gabe beschleunigt die Zeit bis zur vollen Wirkung und verbessert die Wirksamkeit (z. B. 2 x 20mg wirksamer als 1 x 40mg). Die auf dem Markt befindlichen PPI unterscheiden sich relevant in ihrem Effekt auf die intragastrale Azidität als Surrogat für die klinische Effektivität bei GERD.17 Esomeprazol 40mg ist die wirksamste Substanz, Pantoprazol der schwächste PPI. Die Dosierung richtet sich nach der klinischen Manifestation und dem Zulassungsstatus der Präparate. Beispielsweise wird bei einer Refluxösophagitis die höhere Dosis gewählt, während bei Patienten mit NERD (non-erosive reflux disease) eine höhere Dosis keinen besseren klinischen Effekt hervorruft. Die PPI-Therapie sollte bei den meisten Manifestationen von vorneherein zeitlich befristet werden. Für die NERD werden 4 Wochen empfohlen, für die Refluxösophagitis 8 Wochen und für extraösophageale Symptome bis zu 12 Wochen. Eine Doppeldosis (z. B. 2 x 40mg Esomeprazol) sollte auf Ausnahmesituationen beschränkt werden, in denen man eine zuverlässige und intensive Säuresekretionshemmung aus klinischen Erwägungen heraus benötigt. Bei schweren Beschwerden kann durch die Doppeldosis in den ersten Tagen die Zeit bis zum Wirkungseintritt verkürzt werden.
Bei vielen Patienten ist die GERD eine chronische bzw. rezidivierende Erkrankung, sodass Langzeitstrategien erwogen werden müssen.5, 16 Bei schwerer Ösophagitis (Los Angeles Grad C/D) und peptischer Striktur sollte a priori eine PPI-Dauertherapie mit der niedrigsten noch wirksamen Dosis erfolgen. In allen anderen Fällen können neben dieser kontinuierlichen Therapie auch intermittierende Behandlungen bei schubweisem Verlauf und eine sogenannte Bedarfstherapie verordnet werden. Bei der letztgenannten Option nehmen die Patienten eine Standarddosis eines PPI bei Auftreten von Symptomen oder vor Situationen, die erfahrungsgemäß Symptome auslösen. Es sollte nicht mehr als eine Dosis pro Tag eingenommen werden.
PPI haben – trotz der intensiven Sicherheitsdebatte der letzten Jahre – sicher ein sehr gutes Sicherheitsprofil.18 Bei gegebener Indikation ist ihr Nutzen viel größer als ihr Risiko. Die vieldiskutierten „Nebenwirkungen“ (z. B. Demenz, Osteoporose) wurden aus Observationsstudien abgeleitet, die per se keine Differenzierung zwischen Assoziation und Kausalität zulassen. Darüber hinaus lag die Risikoerhöhung in diesen Studien ausnahmslos in einem Bereich, in dem ein Bias wahrscheinlich ist. In der Quintessenz bedeutet dies, dass ein Risiko im Einzelfall nicht mit letzter Sicherheit ausgeschlossen werden kann, falls es tatsächlich existiert, ist es aber sehr klein. Randomisierte, kontrollierte Studien im Vergleich zu einer Fundoplicatio mit bis zu 12 Jahren Follow-up haben keine Auffälligkeiten gezeigt.19 In einer großen, plazebokontrollierten Studie mit 40mg Pantoprazol und 3 Jahre Follow-up (>50.000 Patientenjahre unter Beobachtung) fand sich als einzig auffälliger Befund eine geringe Erhöhung gastrointestinaler Infekte (n = 119 unter Pantoprazol versus n = 90 unter Plazebo, p < 0,05).20 Dies erklärt sich ebenso wie mögliche Resorptionsstörungen in Einzelfällen für z. B. Eisen, Vitamin-B12, Magnesium, Thyroxin aus der Wirkung auf die gastrale Azidität. Zudem haben PPI einen möglichen Einfluss auf Verdauungsprozesse und das Mikrobiom des Darms.21 Nebenwirkungen oder vermeintliche Unverträglichkeiten können in der täglichen Praxis ebenso limitierend sein wie Angst vor unerwünschten Wirkungen bei langfristiger Einnahme.22 Die Sorge um die Verträglichkeit der PPI beeinflusst die Compliance der Patienten sowie das Verordnungsverhalten der Ärzte mit z. T. gefährlichen Konsequenzen.23
2.2 Refluxsymptome – Alternativen und Ergänzungen zur PPI-Therapie
In den letzten Jahren erfuhr die Therapie mit Alginaten eine Renaissance. Dieses beruht auf neuen wissenschaftlichen Erkenntnissen. Bei jedem Menschen bildet sich kurz nach der Nahrungsaufnahme eine Säureansammlung von 50–70ml auf dem Nahrungsbrei im Magen unmittelbar unterhalb der Cardia (sog. Acid Pocket).24, 25 Liegt eine Refluxkrankheit mit Inkompetenz der Antirefluxbarriere vor, fließt der Inhalt dieser Acid Pocket zurück in die Speiseröhre und kann postprandiales Sodbrennen auslösen. Dies ist insbesondere dann relevant, wenn die Acid Pocket in einer Hernie liegt.26 Studien haben gezeigt, dass Alginate aus einem Alginat-Antazidum-Gemisch in dieser Acid-Pocket ausfallen und eine gelartige Schicht auf der Oberfläche der Säureansammlung bilden, die mechanisch Refluxereignisse verhindert.27 Hinzu kommt noch, dass Alginate nach Kontakt dem Speiseröhrenepithel anhaften und eine Schutzschicht bilden.28 Aufgrund dieser Erkenntnisse ist die Acid Pocket heute Teil des pathogenetisch-pathophysiologischen Konzepts der GERD und wird als wichtiges Ziel der pharmakologischen Therapie der GERD angesehen.29
Studien mit Alginaten haben gezeigt, dass diese
- rasch wirken (Wirkungseintritt innerhalb von 5 Minuten)30,
- wirksamer sind als Plazebo oder Antazida31, 32,
- bei milder bis moderater GERD vergleichbar wirksam sind wie 20mg Omeprazol33,
- bei Sodbrennen in der Schwangerschaft erfolgreich eingesetzt werden können.34
Aufgrund dieser Daten stellen Alginate durchaus eine Alternative zu einer PPI-Therapie in der Behandlung von Refluxsymptomen dar. In der neuen deutschen Leitlinie werden sie bei genügender Symptomkontrolle als Alternative zu PPI sowohl in der Akut- als auch in der Langzeittherapie empfohlen, sofern keine gravierenden Schäden in der Speiseröhre vorliegen.
Antazida werden häufig in der Selbstmedikation eingesetzt. Sie führen zu einer raschen Symptomkontrolle und eignen sich daher für die Behandlung gelegentlicher Refluxsymptome.35 H2-Rezeptoragonisten sind bei GERD deutlich schlechter wirksam als PPI, zudem klingt ihre Wirkung bei regelmäßiger Einnahme sukzessive ab (Tachyphylaxie).5 Prokinetika – ohnehin in Deutschland nur zeitlich begrenzt einsetzbar (5–7 Tage) – haben bestenfalls eine schwache Wirkung bei GERD. Baclofen ist wirksam, kommt aber aufgrund des Nebenwirkungsprofils für einen breiten Einsatz nicht in Betracht. Positive Erfahrungen mit allerdings limitierten Studiendaten gibt es auch für Sucralfat, Chondroitinsulfat-Hyaluronsäure, Heilerde und Feigenextrakt.
2.3 Peptische Striktur
Eine symptomatische peptische Striktur sollte vorsichtig endoskopisch kontrolliert bougiert oder mit einem Ballon dilatiert werden.36 Die Implantation eines Stents hat sich nicht bewährt. Anschließend ist eine PPI-Therapie, oftmals in doppelter Standarddosis, auf Dauer erforderlich.5, 7 Bei häufig rezidivierender Stenosierung kann eine lokale Steroid-Injektion vor erneuter Bougierung erwogen werden. Bei unkontrollierbarem Reflux und rezidivierender Stenose sollte auch immer eine Antireflux-Operation diskutiert werden.
2.4 Barrett-Ösophagus
Der Barrett-Ösophagus, definiert als Ersatz des Plattenepithels der Speiseröhre durch ein Zylinderepithel mit spezialisierter intestinaler Metaplasie, stellt per se keine gesicherte Indikation zur medikamentösen Therapie dar, d. h. der Einsatz eines PPI richtet sich nach dem Beschwerdebild und dem Vorhandensein bzw. Ausmaß begleitender erosiver bzw. ulzeröser Läsionen und folgt den Regeln der Symptom- und Ösophagitistherapie.5 Eine im Hinblick auf die Neoplasie-Entwicklung präventive Therapie ist bisher nicht etabliert. In einer großen, randomisierten und kontrollierten Langzeitstudie konnte mit hochdosierter PPI-Therapie (2 x 40mg Esomeprazol) plus 300mg ASS eine günstige Beeinflussung des kombinierten Endpunkts bestehend aus Mortalität, Adenokarzinom und hochgradige Dysplasie des Ösophagus bei gutem Sicherheitsprofil erzielt werden.37 Die Ergebnisse für die Karzinom- bzw. Dysplasieentwicklung waren in den Subgruppenanalysen dieser Studie nicht signifikant. In einer Metaanalyse zeigte sich ein signifikanter Effekt mit einer Reduktion der Dysplasie-Entwicklung um 53%, allerdings war dieser Effekt nur in amerikanischen und nicht in europäischen Studien nachweisbar.38
2.5 PPI-refraktäre Refluxbeschwerden
2.5.1 Dimension des Problems
Nahezu 50% der Patienten, die wegen Refluxbeschwerden dauerhaft PPI einnehmen, haben eine unzureichende Symptomkontrolle.39, 40
2.5.2 Definitionen
Grundsätzlich muss man bei anhaltenden Beschwerden unter einer Therapie zwischen
- PPI-refraktären Refluxbeschwerden, definiert als anhaltende Symptome nach 8 Wochen adäquat durchgeführter Therapie mit einem PPI, und
- PPI-refraktärer GERD, definiert als anhaltende Beschwerden nach 8(–12) Wochen Therapie mit einer Doppeldosis PPI (1 – 0 – 1) unterscheiden. Diese Differenzierung ist praktisch relevant, da „Refluxbeschwerden“ nicht zwangsläufig mit einer GERD gleichzusetzen sind und eine Fehlinterpretation zu katastrophalen Fehlentscheidungen führen kann. Weiterhin sollte unterschieden werden zwischen
- partiellem PPI-Response, definiert als Besserung aber nicht Beseitigung, und
- fehlendem PPI-Response.
Diese Unterscheidung ist klinisch relevant, da ein komplett fehlendes Ansprechen auf PPI a priori gegen eine klassische GERD als Ursache der klinischen Symptomatik spricht. Bei partiellem PPI-Response sollte immer eruiert werden, welche Symptome nicht oder nicht so gut ansprechen, da Begleiterkrankungen (z.B. Reizdarmsyndrom) bei GERD-Patienten häufig sind. Etwa 20% der Refluxpatienten haben eine Vielzahl von Symptomen, die die Kriterien einer Somatisierungsstörung erfüllen.41
2.5.3 Abklärung
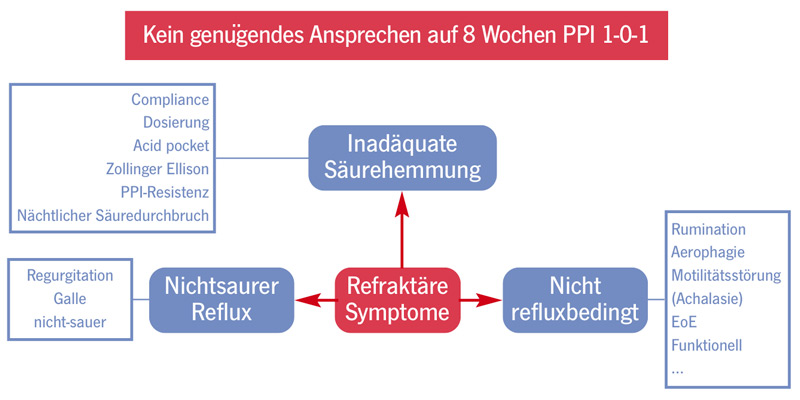
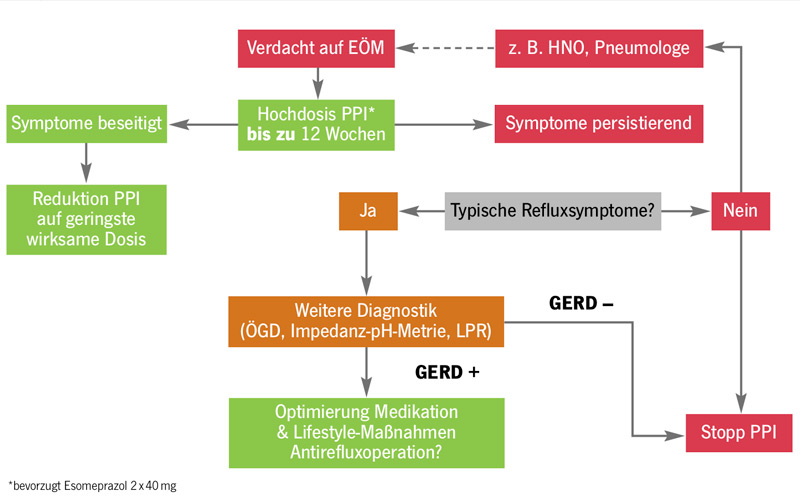
Bei PPI-refraktären Refluxbeschwerden ist ein stratifiziertes Vorgehen von entscheidender Bedeutung, da das Ursachenspektrum ausgesprochen vielfältig ist und Fehleinschätzungen vermieden werden müssen (Abb. 4).42 In der neuen Leitlinie der DGVS wird ein evidenzbasierter Algorithmus publiziert werden, bei dessen Einhaltung eine Klärung der Ursache des Versagens der PPI-Therapie auf die Refluxbeschwerden im Regelfall gelingen wird (Abb. 5).
Extraösophageale Symptome (Laryngitis mit Globusgefühl, Räusperzwang und Stimmproblemen, Husten, Asthma, dentale Erosionen) stellen eine besondere diagnostische und therapeutische Herausforderung dar. Auch hier empfiehlt es sich, einem evidenzbasierten Algorithmus zu folgen (Abb. 6).
2.5.4 Therapie
2.5.4.1 Refluxsymptome
Bei persistierenden Refluxsymptomen und gesicherter GERD sollte die korrekte und zuverlässige Einnahme des PPI überprüft werden. Darüber hinaus stehen Allgemeinmaßnahmen, eine Optimierung der PPI-Therapie (Dosierung, Präparat), eine sinnvolle Kombinationstherapie und schließlich endoskopische und operative Interventionen zur Verfügung (Abb. 7).43 Die Auswahl der Therapiemodalität sollte pathophysiologisch begründet anhand der Befunde der endoskopischen und der Funktionsdiagnostik erfolgen.
Optimierung PPI-Therapie
PPI sollen ca. 30 Minuten vor einer Mahlzeit eingenommen werden. Zudem sind die PPI nicht untereinander austauschbar, wenn als Kriterium die Beeinflussung der gastralen Azidität zugrunde gelegt wird. Esomeprazol 40mg ist der wirksamste PPI – Pantoprazol die schwächste Substanz, und alle anderen liegen dazwischen. Eine optimale Therapie sind 2 x 40mg Esomeprazol. Sprechen Symptome darauf nicht an, spielt Säure eine untergeordnete bzw. keine Rolle.
„Add-on“-Therapie
Bei partiellem, aber unzureichendem PPI-Response kann eine Kombinationstherapie sinnvoll sein. Diese sollte pathophysiologisch begründet und im Idealfall auch durch entsprechende Studien validiert worden sein. Unter Berücksichtigung dieser Aspekte sind folgende Empfehlungen möglich:
▶ Sinnvolle Kombinationspartner
- Alginat (Elimination Acid Pocket + Schleimhautschutz)
- Baclofen (Tonisierung unterer Ösophagussphinkter – Reduzierung Refluxepisoden)
- Chondroitinsulfat – Hyaluronsäure (Mukosaprotektion)
- Antidepressiva (TCA, SSRI, SNRI) – Modulation der ösophagealen Sensitivität
▶ Theoretisch ja, aber… keine (genügende) Evidenz verfügbar
- H2-Blocker zur Nacht
- Gallensäurebinder
- Sucralfat
- Antazida, Heilerde, Feigenextrakt
- Pregabalin, Gabapentin
▶ Nicht sinnvoll
- Prokinetika (ggf. Versuch bei nachgewiesener Magenentleerungsstörung)
Im Einzelfall ist sicher auch eine Tripel-Therapie möglich. Allerdings sollte man in derartigen Fällen immer auch über eine Antireflux-Intervention nachdenken, da der Effekt einer intensivierten Therapie in dieser Situation signifikant geringer ist als der einer Antireflux-Operation.43
2.5.4.2 Nicht heilende Refluxösophagitis
Leichte Fälle (Los Angeles Grad A/B) heilen zuverlässig innerhalb von 8 Wochen ab, schwere Fälle persistieren in 15–35% der Patienten auch noch nach achtwöchiger Behandlung mit einem PPI.44 Aus diesem Grund und wegen einer möglichen Demaskierung einer Barrett-Metaplasie in der Abheilungsphase wird eine endoskopische Heilungskontrolle empfohlen. Im ersten Schritt sollten bei unzureichender Wirksamkeit des PPI Allgemeinmaßnahmen intensiviert und die PPI-Therapie optimiert werden. Falls dies nicht genügt, ist bei zufrieden stellender Symptomkontrolle und leichter Restösophagitis eine abwartende Haltung gerechtfertigt, andernfalls muss eine spezialisierte Abklärung mit Prüfung der Operationsindikation erfolgen.5, 7
2.5.4.3 Regurgitation-dominante GERD
Steht die Regurgitation, evtl. mit Aspiration und Luftnotattacken im Vordergrund, kann von einer alleinigen medikamentösen Therapie nur selten eine zufrieden stellende Lösung erwartet werden. Viele dieser Patienten haben größere Hiatushernien, die diesen Volumenreflux begünstigen. Bei nächtlichen Regurgitationen, die oftmals als besonders belastend empfunden werden, empfehlen sich Lagerungsmaßnahmen. Durch die abendliche Gabe eines PPI (vor dem Abendessen, nicht zur Nacht!) wird die Magensaftproduktion etwas reduziert und der pH-Wert des Refluats angehoben. Die zusätzliche Einnahme von einem Alginat vor dem Schlafengehen oder auch Baclofen zur Verbesserung der Sphinkterfunktion sind Optionen ohne bisher vorliegende schlüssige Evidenz durch kontrollierte Studien. Bei unbefriedigender Symptomkontrolle und Nachweis einer Hernie empfiehlt sich eine Operation.44
2.5.4.4 Extraösophageale Symptome
Symptome wie Globusgefühl, Räusperzwang, Stimmprobleme und chronisch (unerklärter) Husten werden häufig von Patienten und HNO-Ärzten ursächlich mit einer GERD in Zusammenhang gebracht. Diese Konstellation wird oft – v. a. auch in Laienmedien – als „stiller Reflux“ bezeichnet. Ursprünglich verstand man hierunter allerdings Refluxschäden wie Ösophagitis und Barrett in der Speiseröhre ohne klinische Symptomatik.45 Gemeint sind hier extraösophageale Symptome ohne typische Refluxsymptome. Der Terminus suggeriert dabei, dass Reflux die Grundlage der klinischen Problematik ist. Ein kausaler Zusammenhang ist aber vermutlich viel seltener als bisher geglaubt.10 In Abb. 5 findet sich ein pragmatischer Algorithmus zum Management dieses klinischen Problems. Es wäre durchaus wünschenswert, wenn primär eine Diagnostik erfolgte und nicht eine probatorische Therapie. Aufgrund der Häufigkeit des Problems und der sehr limitierten diagnostischen Ressourcen ist dies allerdings nicht praktikabel.
2.5.4.5 Endoskopische Therapie
Vor jeder interventionellen Therapie – sei es endoskopisch oder operativ – muss die Diagnose einer GERD gesichert und als Ursache der Beschwerden bzw. des klinischen Problems identifiziert sein. Zudem sollten signifikante (primäre) Motilitätsstörungen (z. B. Achalasie) und eine eosinophile Ösophagitis ausgeschlossen werden.
Seit vielen Jahren wird versucht, die GERD endoluminal zu behandeln.46 Mit diesem Ansatz kann es nicht gelingen, eine Hiatushernie zu beseitigen. Dementsprechend kann es nur darum gehen, den gastroösophagealen Übergang über einen endoluminalen Zugang einzuengen bzw. den unteren Ösophagussphinkter zu stärken. In kontrollierten Studien waren Verfahren wirksam, die vom Magen aus mit transmuralen Techniken zu einer Raffung des Hiatus führten (GerdX – ehemals Plicator, TIF, MUSE).47 Die Wirkung lässt bei einem Teil der Patienten im Laufe der Jahre nach, eine Wiederholung ist aber prinzipiell möglich. Grundsätzlich kommen solche Eingriffe für Patienten in Betracht, die nicht mit PPI erfolgreich behandelt werden können und einen etablierten operativen Eingriff nicht wünschen. Auch sollte keine (relevante) Hernie vorliegen.48 Ein neuer Eingriff ist die ausgedehnte endoskopische Mucosaresektion oder -ablation im Bereich der Cardia, die vermutlich über Vernarbungsprozesse zu einer Reduktion des Refluxes führt. Eine abschließende Bewertung dieses Konzepts kann momentan auf der Basis der publizierten Daten noch nicht vorgenommen werden.
2.5.4.6 Antireflux-Operation
Seit Jahrzehnten ist die Fundoplicatio das Standardverfahren zur operativen Therapie der GERD. Von dem auch heute noch gebräuchlichen Vorgehen nach Nissen (Vollmanschette) gibt es verschiedene Varianten (z. B. Toupet – Teilmanschette), die darauf abzielten, das Risiko für unerwünschte Folgen zu senken. Insgesamt erhält bisher nur ein kleiner Bruchteil der Refluxpatienten einen operativen Eingriff (<1%). In der Vor-COVID-Ära waren es gut 10.000 Antireflux-Operationen pro Jahr in Deutschland. Gefürchtete Nebenwirkungen sind Dysphagie und Gasbloat-Syndrom.49, 50 Auch kommt es bei einem Teil der Patienten zu einem Wirkungsverlust im Laufe der Jahre mit der Notwendigkeit erneuter medikamentöser Therapie oder einer Rezidivoperation. Auf der Basis einer Cochrane Metaanalyse ist die Nutzen-Risiko-Bewertung für diesen Eingriff weiterhin unklar.51 Bei größeren Hiatushernien mit konservativ unzureichender Symptomkontrolle gibt es aber auch zu einem operativen Eingriff keine Alternative. Die alleinige Rekonstruktion des Hiatus (Hiatoplastik) und/oder des His´schen Winkels ist regelhaft nicht von Dauer. Antirefluxoperationen sollten nur in Zentren mit besonderer Expertise durchgeführt werden. Populationsbasierte Daten aus Skandinavien haben klar gezeigt, dass das Risiko für Morbidität und Mortalität von der Fallzahl der operierenden Klinik maßgeblich bestimmt wird. Bei weniger als 47 Eingriffen pro Jahr stieg die Komplikationsrate deutlich an.52 Weitere unabhängige Risikofaktoren waren Alter und Komorbidität.
Der schlechte Ruf der Fundoplicatio und die mit diesem Eingriff verbundenen Risiken haben zur Entwicklung und Evaluation weniger invasiver Eingriffe geführt, die auch heute schon zur Verfügung stehen. Bei einem Verfahren wird ein Ring aus kleinen Magneten um den unteren Ösophagus gelegt. Die Magneten weichen bei Zunahme des intraluminalen Drucks auseinander und erlauben so den Durchtritt von Speisen. Die Wirksamkeit des Verfahrens ist belegt, allerdings fehlt der unmittelbare Vergleich zu den etablierten Standardoperationsverfahren.53 Die unerwünschten Wirkungen sind ähnlich wie bei der Fundoplicatio. Hinzu kommt das Risiko der Penetration des Fremdmaterials in das Lumen. Eine weitere (neue) und vielversprechende Option ist die Sicherung der Rekonstruktion des His´schen Winkels durch Implantation eines nicht resorbierbaren Device in den Magenfundus in Angrenzung an den unteren Ösophagussphinkter (RefluxStopTM).54 Die elektrische Stimulation des unteren Ösophagus-Sphinkters steht aktuell nicht zur Verfügung. Die neuen Operationsverfahren sollten keinesfalls unkritisch durchgeführt werden. Wünschenswert ist die Durchführung nur bei sorgfältig ausgewählten und diagnostizierten Patienten in entsprechend qualifizierten Zentren.
In der Neuauflage der S2k-Leitlinie der Deutschen Fachgesellschaften wird der Stellenwert einer operativen Antirefluxtherapie klar beschrieben. Demnach sollte sie angeboten werden bei langjährigem, gesicherten Reflux und komplizierte GERD mit schwerer Refluxösophagitis (Los Angeles Grad C und D) oder peptischer Striktur. Weitere mögliche Indikationen sind ein unzureichender Effekt oder eine Unverträglichkeit einer adäquat durchgeführten medikamentösen Therapie bei gesicherter Refluxgenese der Beschwerden bzw. des klinischen Problems. Hierzu soll im Vorfeld immer eine Impedanz-pH-Metrie mit Überprüfung der Symptomassoziation sowie eine hochauflösende Manometrie der Speiseröhre durchgeführt werden.
Am häufigsten wird sich die Frage einer Antireflux-Operation vermutlich bei Patienten mit unzureichendem PPI-Effekt stellen. Bei gesicherter Refluxkrankheit ist die Operation auch einer intensivierten Therapie (PPI + Baclofen + Antidepressivum) signifikant und klinisch relevant überlegen.43 Folgende Kriterien sollen leitliniengerecht vor einer Antirefluxoperation beim Erwachsenen wegen PPI-refraktärer Situation evaluiert werden. (für die Indikationsstellung der Operation müssen aber nicht alle zutreffen):
- Typische Symptome (Anamnese),
- Dauer, Art und Therapie der Refluxkrankheit (Anamnese),
- Positiver PPI-Response,
- Änderung der PPI Therapie (doppelte Standarddosis PPI, PPI-Wechsel, Dosis-Splitting),
- Präsenz einer Hiatushernie (Endoskopie, Radiographie, hochauflösende Manometrie),
- Inkompetente Antirefluxbarriere (hochauflösende Manometrie), Pathologische Säureexposition mit Symptomkorrelation (pH-Metrie, Impedanz-pH-Metrie, SAP [Symptom-Association-Probability]),
- Veränderung (Reduktion) der Lebensqualität.
IV. Fazit – was bleibt, was ist neu?
- Unterscheide zwischen Refluxbeschwerden und Refluxkrankheit.
- In der Primärversorgung geht es in erster Linie um das Management von Refluxbeschwerden mit dem Ziel der aus Patientensicht genügenden Symptomkontrolle.
- Bei Risikofaktoren für einen komplikativen Verlauf und/oder Alarmsymptomen sollte primär endoskopiert werden.
- PPI spielen weiterhin eine wichtige Rolle in der Therapie, bei genügender Wirksamkeit sind Alternativen in Betracht zu ziehen oder sogar zu bevorzugen.
- Bei PPI-refraktären Refluxbeschwerden ist eine eingehende Abklärung angezeigt.
- Der neue diagnostische Goldstandard zum Nachweis bzw. Ausschluss einer GERD ist eine Kombination aus Endoskopie mit Biopsien (der Speiseröhre), Impedanz-pH-Metrie und hochauflösender Manometrie.
- Bei PPI-refraktärer GERD kommen pathophysiologisch orientierte Kombinationsbehandlungen in Betracht.
- Antireflux-Operationen wird ein höherer Stellenwert eingeräumt: Unzureichende medikamentöse Symptomkontrolle, Unverträglichkeit oder nicht gewünschte Fortsetzung einer wirksamen medikamentösen Therapie sind etablierte Indikationen. Zudem sollte allen Patienten mit langjähriger, schwerer Refluxösophagitis (Los Angeles Grad C und D) und/oder peptischer Striktur eine Antireflux-Operation angeboten werden.
Für die Verfasser
Prof. Dr. med. Joachim Labenz, Refluxzentrum Siegerland, Diakonie Klinikum,
Jung-Stilling-Krankenhaus, Akademisches Lehrkrankenhaus der Universität Bonn, Wichernstr. 40, 57074 Siegen.
Literatur
1 Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, Global Consensus Group. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006; 101: 1900–20
2 Labenz J, Labenz C. Prävalenz und natürlicher Verlauf der gastroösophagealen Refluxkrankheit. Gastroenterologe 2016; 11: 102–9
3 El-Serag HB, Sweet S, Winchester CC, Dent J. Update on the epidemiology of gastro- oesophageal reflux disease: A systematic review. Gut 2014; 63: 871–80
4 Vaezi MF, Sifrim D. Assessing old and new diagnostic tests for gastroesophageal reflux disease. Gastroenterology 2018; 154: 289–301
5 Koop H, Fuchs KH, Labenz J et al. S2k guideline: gastroesophageal reflux disease guided by the German Society of Gastroenterology: AWMF register no. 021-013. Z Gastroenterol 2014; 52: 1299–1346
6 Tack J, Pandolfino JE. Pathophysiology of gastroesophageal reflux disease. Gastroenterology 2018; 154: 277–88
7 Boeckxstaens G, El-Serag HB, Smout AJPM, Kahrilas PJ. Symptomatic reflux disease: the present, the past and the future. Gut 2014; 63: 1185–93
8 Irani MZ, Talley NJ, Ronkainen J et al. Neutrophils, eosinophils, and intraepithelial lympho cytes in the squamous esophagus in subjects with and without gastroesophageal reflux symptoms. Hum Pathol 2021; 115: 112–22
9 Gyawali CP, Kahrilas PJ, Savarino E et al. Modern diagnosis of GERD: the Lyon consensus. Gut 2018; 67: 1351–62
10 Vaezi MF, Katzka D, Zerbib F. Extraesophageal symptoms and diseases attributed to GERD: where is the pendulum swinging now? Clin Gastroenterol Hepatol 2018; 16: 1018–29
11 Ness-Jensen E, Lindam A, Lagergren J, Hyeem K. Weight loss and reduction in gastro esophageal reflux. A prospective population-based cohort study: the HUNT study. Am J Gastroenterol 2013; 108: 376–82.
12 Triadafilopoulos G, Korzilius JW, Zikos et al. Ninety-six hour wireless esophageal pH study in patients with GERD shows that restrictive diet reduces esophageal acid exposure. Dig Dis Sci 2020; 65: 2331–44
13 Mehta RS, Nguyen LH, Ma W, Staller K et al. Association of diet and lifestyle with the risk of gastroesophageal reflux disease. JAMA 2021; 181: 552–4
14 Labenz J, Anschütz M, Walstab J et al. Heilwasser reduziert Sodbrennen: Randomisierte, placebokontrollierte Phase-III-Studie (STOMACH STILL). Z Gastroenterol 2022; 60: e412–e413
15 Labenz J, Koop H. Gastroösophageale Refluxkrankheit – was tun, wenn PPI nicht ausreichend wirksam, verträglich oder erwünscht sind? Dtsch Med Wochenschr 2017; 142: 356–66
16 Katzka DA, Pandolfino JE, Kahrilas PJ. Phenotypes of gastroesophageal reflux disease: where Rome, Lyon, and Montreal meet. Clin Gastroenterol Hepatol 2020; 18: 76776
17 Kirchheiner J, Glatt S, Fuhr U et al. Relative potency of proton-pump inhibitors – comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65: 19–31
18 Spechler SJ. Proton pump inhibitors: what the internist needs to know. Med Clin North Am 2019; 103: 1–14
19 Attwood SE, Ell C, Galmiche JP, Fiocca R et al. Long-term safety of proton pump inhibitor therapy assessed under controlled, randomised clinical trial conditions: data from the SOPRAN and LOTUS studies. Aliment Pharmacol Ther 2015 41: 1162–74
20 Moayyedi P, Eikelboom JW, Bosch J et al. Safety of proton pump inhibitors based on a large, multi-year, randomized trial of patients receiving rivaroxaban or aspirin. Gastroenterology 2019; 157: 682–91
21 Jackson MA, Goodrich JK, Maxan ME, Freedberg DE, Abrams JA, Poole AC et al. Proton pump inhibitors alter the composition of the gut microbiota. Gut 2016; 65: 749–56
22 Kurlander JE, Kennedy JK, Rubinstein JH et al. Patients´perceptions of proton pump inhibitor risks and attempts at discontinuation: a national survey. Am J Gastroenterol 2019; 114: 244–49
23 Kurlander JE, Rubinstein JH, Richardson CR et al. Physican´s perceptions of proton pump inhibitor risks and recommendations to discontinue: a national survey. Am J Gastroenterol 2020; 115: 689–96
24 Fletscher J, Wirz A, Young J, Vallance R, McColl KE. Unbuffered highly acidic gastric juice exists at the gastroesophageal junction after a meal. Gastroenterology 2001; 121: 775–83
25 Mitchell DR, Derakhshan MH, Robertson EV, McColl KE. The role of the acid pocket in gastroesophageal reflux disease. J Clin Gastroenterol 2016; 50: 111–9
26 Beaumont H, Bennink RJ, de Jong J, Boeckxstaens GE. The position of the acid pocket as a major risk factor for acidic reflux in healthy subjects and patients with GORD. Gut 2010; 59: 441–51
27 Rohof WO, Bennink RJ, Smout AJ et al. An alginate-antacid formulation localizes to the acid pocket to reduce acid reflux in patients with gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2013; 11: 1585–91
28 Woodland P, Batista-Lima F, Lee C et al. Topical protection of human esophageal mucosal integrity. Am J Physiol Gastrointest Liver Physiol 2015; 308: G975–80
29 Sauer M, Fox MR. The acid pocket – a novel target for the treatment of gastro-esophageal reflux disease. Z Gastroenterol 2018; 56: 1276–82
30 Strugala V, Dettmar PW, Sarratt K et al. Randomized, controlled, crossover trial to inves tigate times to onset of the perception of soothing and cooling by over-the-counter heartburn treatments. J Int Med Res 2010; 38: 449–57
31 Thomas E, Wade E, Crawford G et al. Randomised clinical trial: relief of upper gastrointestinal symptoms by an acid pocket-targeting alginate-antacid (Gaviscon Double Action) – a double-blind, placebo-controlled, pilot study in gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2014; 39: 595–602
32 Leiman DA, Riff BP, Morgan S et al. Alginate therapy is effective treatment for GERD symptoms: a systematic review and meta-analysis. Dis Esophagus 2017; 30: 1–9
33 Pouchain D, Bigard MA, Liard F et al. Gaviscon® vs. omeprazole in symptomatic treatment of moderate gastroesophageal reflux. A direct comparative randomised trial. BMC Gastroenterol 2012; 23: 12–8
34 Thélin CS, Richter JE. Review article: the management of heartburn during pregnany and lactation. Aliment Pharmacol Ther 2020; 51: 421–34
35 Konturek JW, Beneke M, Koppermann R et al. The efficacy of hydrotalcite compared with OTC famotidine in the on-demand treatment of gastroesophageal reflux disease: a non-inferiority trial. Med Sci Monit 2007; 13: CR44–9
36 Desai M, Hamade N, Sharma P. Management of peptic strictures. Am J Gastroenterol 2020; 115: 967–70
37 Jankowski JAZ, de Caestecker J, Love SB et al. Esomeprazole and aspirin in Barrett´s oesophagus (AspECT): a randomised factorial trial. Lancet 2018; 392; 400–8
38 Delshad SD, Almario CV, Chey WD, Spiegel BMR. Prevalence of gastroesophageal reflux disease and proton pump inhibitor-refractory symptoms. Gastroenterology 2020; 158: 120–6
39 El-Serag H, Becher A, Jones R. Systematic review: persistent reflux symptoms on proton pump inhibitor therapy in primary care and community studies. Aliment Pharmacol Ther 2010; 32: 720–37
40 Labenz J, Labenz G, Stephan D, Willeke F, LOPA-Studiengruppe. Unzureichende Symp tomkontrolle unter Langzeittherapie mit PPI bei GERD – Fakt oder Fiktion? MMW Fortschr Med 2016; 158 (S4): 7–11
41 Fuchs KH, Musial F, Ulbricht F et al. Foregut symptoms, somatoform tendencies, and the selection of patients for antireflux surgery. Dis Esophagus 2017; 30: 1–10
42 Spechler SJ, Hunter JG, Jones KM et al. Randomized trial of medical versus surgical treatment for refractory heartburn. N Engl J Med 2019; 381: 1513–23
43 Zerbib F, Bredenoord AJ, Fass R et al. ESNM/ANMS consensus paper: Diagnosis and management of refractory gastro-esophageal reflux disease. Neurogastroenterol Motil. 2021 Apr; 33(4): e14075. DOI: 10.1111/nmo.14075
44 Hunt RH, Yuan Y, Scarpignato C. Editorial: healing of refractory reflux oesophagitis – an ongoing unmet clinical need. Aliment Pharmacol Ther 2014; 40: 987–9
45 Bell R, Lipham J, Louie B et al. Magnetic sphincter augmentation superior to proton pump inhibitors for regurgitation in a 1-year rendomized trial. Clin Gastroenterol Hepatol 2020; 18: 1736–43
46 Fass R, Dickman R. Clinical consequences of silent gastroesophageal reflux. Curr Gastroenterol Rep 2006; 8: 195–201
47 Kalapala R, Karyampudi A, Nabi Z et al. Endoscopic full-thickness plication for the treatment of PPI-dependent GERD: results from a randomised, sham-controlled trial. Gut 2022; 71: 686–94
48 Wannhoff A, Caca K. Endoskopische Therapieverfahren bei gastroösophagealer Refluxkrankheit. Verdauungskrankheiten 2019; 37: 1–7
49 Gyawali CP, Fass R. Management of gastroesophageal reflux disease. Gastroenterology 2018; 154: 302–18
50 Yadlapati R, Hungness ES, Pandolfino JE. Complications of antireflux surgery. Am J Gastroenterol 2018; 113: 1137–47
51 Garg SK, Gurusamy KS. Laparoscopic fundoplication surgery versus medical management for gastro-oesophageal reflux disease (GORD) in adults. Cochrane Database Syst Rev 2015; 11: CD003243. DOI:10.1002/14651858.CD003243.pub3
52 Yanes M, Santoni G, Maret-Ouda J et al. Mortality, reoperation, and hospital stay within 90 days of primary and secondary antireflux surgery in a population-based multinational study. Gastroenterology 2021; 160: 2283–90
53 Skubleny D, Switzer NJ, Dang J et al. LINX® magnetic esophageal sphincter augmentation versus Nissen fundoplication for gastroesophageal reflux disease: a systematic review and meta-analysis. Surg Endosc 2017; 31: 3078–84
54 Bjelovi M, Harsányi L, ÁAltorjay Á et al. Non-active implantable device treating acid reflux with a new dynamic treatment approach: 1-year results. BMC Surgery 2020; 20: 159–71