Mittlerweile ist die nicht-alkoholische Fettlebererkrankung (NAFLD) die häufigste chronische Lebererkrankung in Deutschland. Für 2030 wird in Deutschland mit 20,9 Millionen NAFLD Patienten gerechnet und davon bis zu einer halben Millionen Patienten mit einer NASH Zirrhose. Die Zunahme der Erkrankung ergibt sich aus der kontinuierlichen Zunahme von Übergewicht und Adipositas in Deutschland, da die NAFLD als eine Komponente des metabolischen Syndroms mit Insulinresistenz oder Diabetes mellitus Typ 2, arterieller Hypertonie und Dyslipidämie beschrieben wird. Problematisch ist, dass sich in 5–20% der Fälle aus der nicht-alkoholischen Fettleber (NAFL) eine nicht-alkoholische Steatohepatitis (NASH) mit Entzündung des Lebergewebes entwickelt, die zur Leberzirrhose und hepatozellulärem Karzinom (HCC) voranschreiten kann. Im klinischen Alltag sollten Risikopatienten, d.h. Patienten mit einer relevanten Fibrosierung durch einen zweistufigen Algorithmus mit nicht-invasiven Fibrosescores und transienter Elastographie identifiziert werden, denn diese Patientengruppe weist eine erhöhte Mortalität im Vergleich zur Normalbevölkerung auf. Die Therapie des metabolischen Syndroms und der Risikofaktoren steht bei den NAFLD-Patienten im Vordergrund. Derzeit werden aber auch verschiedene Wirkstoffe spezifisch für die NASH in klinischen Studien untersucht, sodass in absehbarer Zukunft auch mit einer medikamentösen Therapieoption für Risikopatienten mit höhergradiger Fibrose zu rechnen ist.

PD Dr. Monika Rau, Uniklinik Würzburg

Prof. Dr. Andreas Geier, Uniklinik Würzburg
Diagnose einer NAFLD
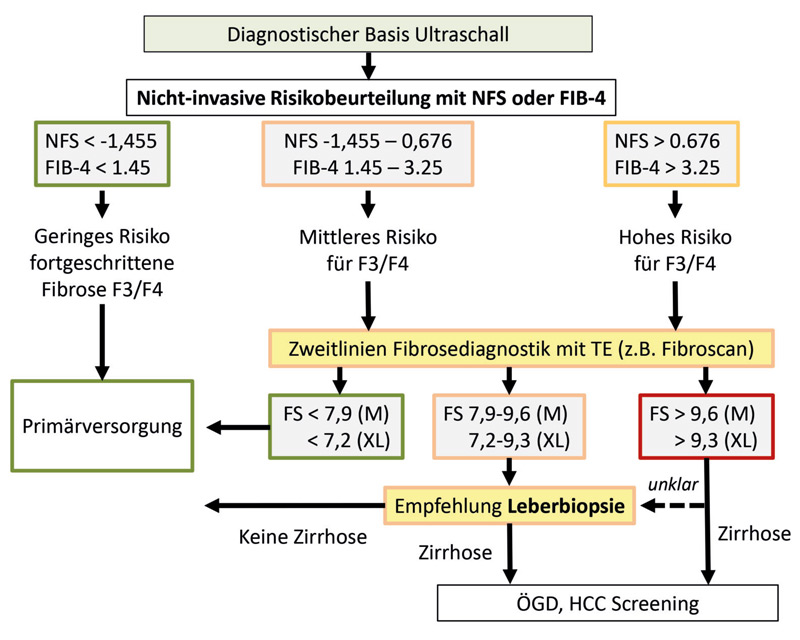
Die Erkrankung wird häufig nicht diagnostiziert, weil NAFLD Patienten sich zumeist ohne spezifische Krankheitssymptome oder mit unspezifischen abdominellen Beschwerden bzw. allgemeiner Schwäche präsentieren.13 Es gibt keine spezifischen Laborwerte, um die Diagnose einer NAFLD zu stellen. In Routinelaboruntersuchungen zeigen sich oft erhöhte Lebertransaminasen (GOT, GPT) oder insbesondere auch eine isolierte GPT-Erhöhung.6 Jedoch können die Leber transaminasen auch bei Patienten mit fortgeschrittener Erkrankung normwertig sein. In der S2k-Leitlinie „Nicht-alkoholische Fettleber erkrankung“ der DGVS, die sich derzeit im Überarbeitungsprozess befindet, wird ein zweistufiger diagnostischer Algorithmus empfohlen (Abb. 1).12 An erster Stelle steht ein nicht-invasiver Risikoscore, der Krankheits-spezifische NAFLD fibrosisrisk score oder der Krankheitsunspezifische Fibrose-4 (FIB-4) Score, die Web-basiert und kostenfrei bereits in der Primärversorgung leicht berechnet werden können. Die Scores beinhalten folgende Parameter: Alter, BMI, DM/gestörte Glukosetoleranz, Thrombozytenzahl, Albumin und den AST/ALT Quotient. Nach der Initialdiagnostik können NFS und FIB-4 darüber hinaus auch seriell im klinischen Alltag eingesetzt werden, um die Krankheitsprogression zu kontrollieren.14
Abdominelle Sonographie und nicht-invasive Fibrosemessung
Die abdominelle Sonographie ist das bildgebende Verfahren der Wahl für eine NAFLD Diagnostik (Abb. 2).
An zweiter Stelle des diagnostischen Algorithmus der S2k-Leitlinie steht die direkte nicht-invasive Fibrosemessung. Hier stehen unterschiedliche elastographische Verfahren zur Verfügung (z. B. Fibroscan, Acoustic Radiation Force Impulse (ARFI), Supersonic shear imaging (SSI)), die eine vergleichbar gute Genauigkeit aufweisen.15 Für die klinische Versorgung relevant ist hier die Detektion einer fortgeschrittenen Fibrose (F3–F4 vs. F0–2). Hier liegt die eigentliche Stärke dieser Verfahren, während frühere Fibrosestadien nur eingeschränkt differenziert werden können. Beim Fibroscan wird allgemein ein oberer Cut-Off Wert von 9,6kPa verwendet. Normale Lebersteifigkeitswerte erlauben eine hohe negative Prädiktion bzgl. einer relevanten Fibrosierung und können im Alltag gut Patienten identifizieren, die zunächst keiner spezialisierten Diagnostik oder Therapie bedürfen. Eine Zusatz funktion in den bisher noch nicht sehr breit verfügbaren Fibroscan-Geräten ermöglicht auch eine Quantifizierung des Fettgehalts in der Leber mittels CAP (controlled attenuation parameter). Die Leberbiopsie zur Histologiegewinnung ist weiterhin der diagnostische Goldstandard, um eine NASH zu diagnostizieren und in Zweifelsfällen Begleiterkrankungen auszuschließen. Eine zukünftige Therapiesteuerung anhand des Fibrosegrades wird zu nehmend über nicht-invasive Testverfahren möglich sein und möglicherweise zum Rückgang der Bedeutung der Leberbiopsie führen.16
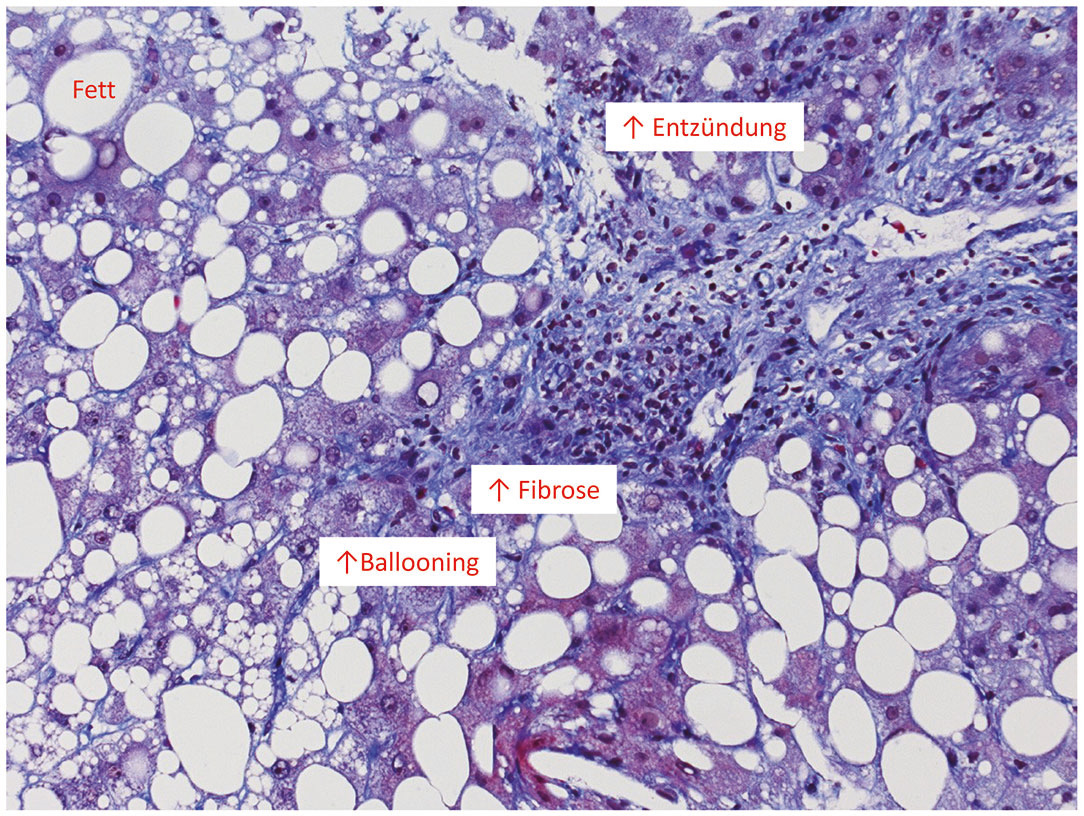
Für eine Differenzierung zwischen NAFL und NASH sowie zur Aktivi tätsbestimmung der NASH, die im klinischen Alltag derzeit wenig Relevanz hat, werden verschiedene histologische Scoring-Systeme zur Beurteilung der Steatose, der Inflammation und der Leberzellschwellung (Ballooning) verwendet, der NAFLD activity score (NAS) sowie der SAFScore (Abb. 3).17, 18 Aufgrund der Invasivität der Biopsie und der Problematik des sampling error besteht eine große Motivation nicht-invasive Verfahren zur Diagnostik weiterzuentwickeln und anzuwenden. Die MR-basierten Techniken zeigen derzeit die beste Möglichkeit einer nicht-invasiven Diagnostik von Leberfettgehalt (Protonen Dichte Fat Fraktion oder PDFF) sowie Fibrose (MR-Elastographie) kommen derzeit aber fast ausnahmslos in Studien zum Einsatz.19 Für alle genannten nicht-invasiven Verfahren ist derzeit aber noch eine eingeschränkte Verfügbarkeit festzuhalten, die es in den nächsten Jahren zu erweitern gilt.
Die Therapie der Risikofaktoren steht an erster Stelle
Hinsichtlich der Therapie gibt es derzeit noch keine spezifische, leber bezogene medikamentöse Therapieoption mit nachgewiesenem Langzeitnutzen für NAFLD Patienten. Aktuell werden jedoch verschiedene Wirkstoffe in klinischen Studien untersucht. Die der zeitigen Studien konzentrieren sich dabei insbesondere auf Risikopatienten, d. h. NASH Patienten mit einem Fibrosestadium ≥2. Unabhängig von der Entwicklung „neuer“ NASH-spezifischer Medikamente steht jedoch an erster Stelle der Therapieempfehlungen die Gewichtsreduktion und Therapie der Risikofaktoren, d. h. der einzelnen Komponenten des metabolischen Syndroms. Empfohlen wird eine anhaltende und moderate Gewichtsreduktion (0,5–1kg/Woche) durch Ernährungsumstellung sowie regelmäßige körperliche Bewegung. Die Gewichtsreduktion sollte idealerweise 7–10% des Körpergewichts erzielen, da ab einer Reduktion von 7% eine Besserung aller histologischen Komponenten der NASH nachgewiesen werden konnte und ab 10% auch ein positiver Effekt auf die Fibrose beobachtet wurde. Für die anhaltende Gewichtsreduktion wird zum einen eine Ernährungsumstellung gemäß einer Mediterranen Kost (reich an unverarbeiteten, vollwertigen Lebensmitteln, hoher Anteil an Ballaststoffen, ungesättigten Fetten und niedriger Anteil von rotem oder verarbeiteten Fleisch sowie raffinierten Kohlenhydraten) empfohlen.21 Neben der Ernährungsumstellung wird zum anderen eine regelmäßige körperliche Aktivität in Form von Ausdauer- oder Krafttraining zur Gewichtsreduktion empfohlen. Die empfohlene Lebensstiländerung ist jedoch nur in 10–20% der Patienten langfristig ausreichend effektiv.20
Therapeutika – aktuelle Entwicklungen
In den letzten Jahren sind daher verschiedene Wirkstoffe mit unterschiedlichen pathophysiologischen Angriffspunkten für die Therapie der NASH untersucht worden. Ein Überblick über die verschiedenen Substanzen und deren pathophysiologischen Angriffspunkte zeigt Abb. 4. Bei Typ-2-Diabetikern mit NASH sind derzeit bereits zwei Substanzen zur antidiabetischen Therapie zugelassen, die auch einen Effekt bei der NASH gezeigt haben: Glucagon-like Peptide-1 (GLP-1) Analoga sind in der derzeitigen Diabetestherapie ein wichtiger Baustein. Liraglutide (Victoza, Saxenda) zeigte als lang-wirksames GLP-1 Analogon, das wie das endogene GLP-1 die Insulinsekretion stimuliert, in einer Phase-II-Studie eine histologische Verbesserung der NASH ohne Verschlechterung der Fibrose.22 Ähnliche Daten sind mittler weile auch für Semaglutid (Ozempic, Rybelsus) verfügbar, das auch mit einer häufigeren Resolution der NASH ohne signifikante Verbesserung der Fibrose assoziiert wurde.23 Auch SGLT1/2 Inhibitoren zeigten bei Patienten mit NAFLD und Typ-2-Diabetes eine signifikante Verbesserung des Leberfettgehalts und weisen Potenzial in der NASH-Therapie auf.
Eine Wirkstoffklasse, die derzeit in der Entwicklung NASH-spezifischer Medikamente am weitesten vorangeschritten ist, sind die FXR Agonisten. Die Obeticholsäure (OCA), ein FXR Agonist, der mittlerweile für die Behandlung der Primärbiliären Cholangitis (PBC) unter dem Namen Ocaliva® in Deutschland zugelassen ist, wird derzeit in zwei Phase-III-Studien (F2–F3 Patienten und F4 Patienten) unter sucht. In einer Interimsanalyse der REGENERATE Studie (F2–F3 Fibrose) nach 18 Monaten erreichten Patienten unter Einnahme von 10mg und 25mg OCA signifikant häufiger (18% und 23%) den primären Endpunkt, d. h. Verbesserung der Fibrose um ≥1 Stadium ohne Verschlechterung der NASH im Vergleich zu 12% der Patienten im Placeboarm.24 Die Therapie mit OCA hat in den bisherigen Studien jedoch eine deutliche Limitation aufgrund der Nebenwirkungen mit einem dosisabhängigen Pruritus und einer LDL-Cholesterolerhöhung.
Resmetirom, ein hochselektiver Thyroidhormonrezeptor β (THRβ) mit potenten anti-steatotischem Effekt wird derzeit ebenfalls in einer Phase-III-Studie untersucht. Der THRβ ist ein in der Leber prädominanter Thyroxinrezeptor, durch den insbesondere der Cholesterolmetabolismus- und Exkretion beeinflusst wird.
Bariatrische Operation
Die bariatrische Operation stellt eine Therapieoption bei Adipositas per magna, d. h. einem BMI >35kg/m² mit Komplikationen oder einem BMI >40kg/m² dar. Insbesondere der Magenbypass mit Roux-Y-Rekonstruktion führt bei schwerer Adipositas zu einer deutlichen Gewichtsreduktion sowie Besserung der diabetischen Stoff wechsel lage.25 Hinsichtlich des positiven Effekts auf die NAFLD gibt es nur unkontrollierte prospektive oder retrospektive Daten, die eine Fibrosereduktion bei ca. 40% der Patienten nahelegen.26 Für Patienten mit dekompensierter Leberzirrhose und weit fortgeschrittenem Krankheitsverlauf steht dann die Lebertransplantation im Vordergrund.
Korrespondierender Autor:
Prof. Dr. Andreas Geier, Leitung Hepatologie, Medizinische Klinik und Poliklinik II, Schwerpunkt Hepatologie, Universitätsklinikum Würzburg, Oberdürrbacher Str. 6, 97080 Würzburg
Mit freundlicher Genehmigung der Falk Foundation e.V. Aktualisierte Zusammenfassung des im Falk Gastro-Kolleg 3/2021 zuerst erschienenen Artikels.
Literatur beim Verlag