SCHNELLE UND PRÄZISE DIAGNOSTIK VON CEPHEID TRÄGT DAZU BEI, ANTIBIOTIKA ZIELGENAU EINZUSETZEN UND RESISTENZEN ZU REDUZIEREN
Antibiotika-Resistenzen nehmen seit Jahren rasch zu und bedrohen die Möglichkeiten zur Behandlung häufiger Infektionskrankheiten. Die COVID-Pandemie hat zu einer weiteren Verschärfung dieser Situation beigetragen. Auf der DGHM-Jahrestagung 2022 wurden mögliche Gegenmaßnahmen vorgestellt. So kann eine schnelle und präzise Diagnostik dazu beitragen, Antibiotika zielgenau einzusetzen und Patienten, die mit arzneimittelresistenten Bakterien besiedelt oder infiziert sind, rasch zu identifizieren, zu isolieren und entsprechend adäquat zu behandeln.
Resistenzen gegenüber Antibiotika stellen nach den Ausführungen von Prof. Dr. Brigitte König, Institut für Medizinische Mikrobiologie und Infektionsepidemiologie am Universitätsklinikum Leipzig, bereits seit der Entwicklung des ersten Antibiotikums – Penicillin im Jahr 1928 – eine Herausforderung dar. Mikroorganismen gelinge es immer wieder, sich durch unterschiedlichste Anpassungsmechanismen der Wirksamkeit von neuen Antibiotika zu entziehen, erklärte König auf einem Symposium von Cepheid bei der 74. Jahrestagung der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM) in Berlin. Dies sei ein ewiger Kreislauf aus der Entwicklung von Antibiotika durch den Menschen, die Infektionen wirksam bekämpfen, und der Entwicklung von Resistenzen durch die Bakterien, die die Wirksamkeit dieser Antibiotika beeinträchtigen, fasste die Expertin zusammen.
Antimikrobielle Resistenzen und ihre Folgen
Antimikrobielle Resistenz (AMR) wird durch einen falschen bzw. übermäßigen Antibiotikaeinsatz sowie unzureichende Prävention und Eindämmung von Infektionen verschärft.1 Die Folgen der antimikrobiellen Resistenz sind eine erhöhte Mortalität und enorme Kosten für die Gesellschaft: Allein in der Europäischen Union (EU) verursacht die AMR jedes Jahr schätzungsweise 33.000 Todesfälle und 1,5 Milliarden Euro zusätzliche Kosten durch Mehrausgaben im Gesundheitswesen und Produktivitätsverluste.1
Auswirkungen von nosokomialen Infektionen
Zudem gibt es einen engen Zusammenhang zwischen AMR und den in Krankenhäusern gefürchteten nosokomialen Infektionen (Healthcare-Associated Infections, HAIs).2 Denn nosokomiale Infektionen werden häufig von arzneimittelresistenten Bakterien verursacht und können das Risiko für die Entwicklung von resistenten Stämmen erhöhen. Jährlich sind in der EU schätzungsweise 4,1 Millionen Menschen von HAIs betroffen, sie haben mindestens 37.000 Todesfälle und Kosten von 7 Milliarden Euro pro Jahr zur Folge. Das European Centre for Disease Prevention and Control schätzt, dass sich durch die Implementierung von Hygiene- und Infektionskontrollprogrammen in Krankenhäusern rund 20–30% der nosokomialen Infektionen verhindern lassen.2
Einfluss von COVID-19 auf antimikrobielle Resistenzen
Die Situation hat sich durch die COVID-19-Pandemie noch weiter zugespitzt. Denn rund 72 % der stationär aufgenommenen COVID-19-Patienten wurden mit Antibiotika behandelt.3 Bei Betroffenen, die auf einer Intensivstation behandelt wurden, lag der Anteil sogar bei 92,5%.4 Doch nur 6,9% der stationär behandelten COVID-19-Patienten hatten tatsächlich eine bakterielle Infektion.3 Dies könnte die Entwicklung der antimikrobiellen Resistenz während der Pandemie in den letzten zwei Jahren weiter vorangetrieben haben.5
Zugleich gibt es Hinweise, dass während der Pandemie die Zahl der Krankenhausinfektionen zugenommen hat: Dem Barmer Krankenhausreport zufolge kam es in den Jahren 2017 bis 2019 noch durchschnittlich in rund 5,6% der Krankenhausfälle zu einer nosokomialen Infektion.6 Zu Beginn der Pandemie stieg dieser Wert auf 6,8%, was einem Zuwachs von über 20% binnen weniger Wochen entspricht. Demnach gab es 2020 deutschlandweit etwa 34.000 zusätzlich Infizierte und bis zu 1.300 weitere Todesfälle aufgrund einer nosokomialen Infektion.6
Resistente Bakterien-Stämme
Inzwischen ist für mehrere Bakterien bekannt, dass bei ihnen die Ausbreitung resistenter Stämme eine besondere Herausforderung darstellt: Carbapenem-resistente Enterobakterien bedrohen Reserveantibiotika7, Methicillin-resistente Staphylococcus-aureus-Stämme (MRSA) sind Hauptverursacher von HAIs8, für Vancomycin-resistente Bakterien gibt es nur noch wenige bzw. keine Behandlungsoptionen9 und die medikamentenresistente Tuberkulose ist weltweit eine häufige Todesursache.10
König nannte bei der DGHM-Jahrestagung als besonders problematisch Carbapenem-resistente Stämme, wie Escherichia coli und Klebsiella pneumoniae. Diese würden bisher zwar insgesamt noch nicht so häufig auftreten, seien aber mit einer sehr hohen Mortalität assoziiert, erklärte sie.11 Zudem seien Carbapenem-resistente Stämme in einigen europäischen Ländern bereits recht weit verbreitet, so dass sie bspw. durch Reisen zunehmend in Deutschland Einzug halten könnten, ergänzte König.11
Kampf gegen antimikrobielle Resistenz
Als eine wichtige Möglichkeit zur Bekämpfung der antimikrobiellen Resistenz nannte König die Vermeidung von Antibiotika-Über- und Fehlverordnungen, die auch die Antibiotic Stewardship Initiative (www.antibiotic-stewardship.de) empfiehlt. Für Ärzte bedeutet das, das richtige Antibiotikum zur richtigen Zeit in der richtigen Dosis zu verschreiben. Patienten müssen das Antibiotikum zugleich korrekt einnehmen, unabhängig von ihrem Befinden. Zudem müssen sie akzeptieren, dass Antibiotika nicht bei Virusinfektionen wirken.
Bei der Auswahl des richtigen Antibiotikums helfen laut König PCR-basierte Schnelltests, die oft bereits innerhalb von einer Stunde anzeigen können, was für eine Art von Infektion bei einem Patienten vorliegt und ob es sich um einen resistenten Stamm handelt. Damit könne sehr schnell entschieden werden, ob eine Antibiotikatherapie sinnvoll sei und – wenn ja – welche, betonte König.
Schnelle PCR-Diagnostik
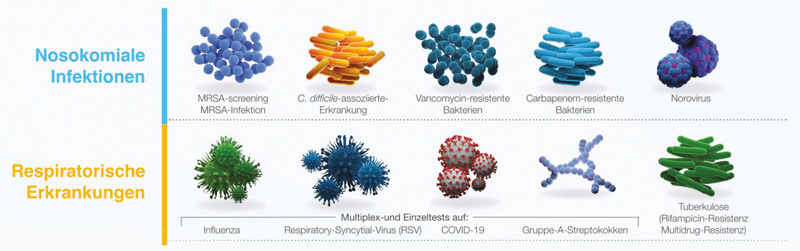
Das GeneXpert® System von Cepheid ermöglicht eine entsprechende Diagnostik (Abb. 1, 2): Ein breites Spektrum an präzisen und einfachen PCR-Schnelltests zeigt eine Reihe von klinisch relevanten Krankheitsbildern zuverlässig an, unter anderem Atemwegserkrankungen, nosokomiale Infektionen und andere Infektionserkrankungen sowie medikamentenresistente Tuberkulose. Die Ergebnisse der meisten Tests liegen innerhalb von ca. einer Stunde vor. Das hilft dem medizinischen Fachpersonal, das Therapiemanagement zu optimieren und die Transmission resistenter Bakterien zu verringern, was zur Verhinderung einer Ausbreitung von Pathogenen und weiteren Resistenzen beiträgt.12, 13
Neue Behandlungsansätze
Neben den Fortschritten in der Diagnostik gibt es gemäß König auch Fortschritte in der Therapie, die zur Bekämpfung der antimikrobiellen Resistenz beitragen. Hierzu gehört die Entwicklung von neuen antibiotischen Verbindungen und auch von neuen antibiotischen Behandlungsstrategien, bei denen die Bioverfügbarkeit der Wirkstoffe erhöht und die Behandlungsdauer verkürzt wird bzw. ein schneller Wechsel zwischen derzeit verfügbaren Antibiotika erfolgt.
Hinzu kommen neue nicht-antibiotische Ansätze wie die Entwicklung von monoklonalen, gegen Bakterien-Stämme gerichteten Antikörpern, die Phagen-Therapie und die Modulation des physiologischen Mikrobioms, die einer Resistenzentwicklung entgegenwirkt. König zeigte sich in Berlin zuversichtlich, dass die Menschen den Kampf um die mikrobielle Resistenz gewinnen können, wenn sie alle bekannten potenziellen Angriffspunkte, wie die Optimierung von Diagnostik und Therapie, konsequent angehen.
(Petra Eiden [pe], Berlin)
Abb. 1: Schnelle, zuverlässige und unmittelbar nutzbare PCR-Ergebnisse: Mit dem bedienerfreundlichen und resourcensparenden GeneXpert® System ist es gelungen, mit einer einzigen Kartuschentechnologie vielfältige Krankheitsbilder diagnostisch abzudecken.
Abb. 2: Das GeneXpert® System bietet medizinischem Fachpersonal eine präzise PCR-Diagnostik für jede Umgebung – vom Zentrallabor bis hin zu patientennahen Anwendungen.
Weitere Informationen unter: www.cepheid.com/de
Quellen:
Literatur & Symposium „Darwinopoly – Wer gewinnt auf dem Spielfeld der Resistenz – Bakterien oder Menschen?“ anlässlich der 74. Jahrestagung der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM), 6. September 2022, Berlin. Veranstalter: Cepheid.
In Kooperation mit der Cepheid GmbH
__________
1 1 EU Action on Antimicrobial Resistance: health.ec.europa.eu/antimicrobial-resistance/eu-action-antimicrobial-resistance_en; letzter Abruf: 4.10.2022
2 MedTech Europe. 2014. Healthcare-Associated Infections Brochure: www.medtecheurope.org/resource-library/hai-brochure; letzter Abruf: 4.10.2022
3 Langford B et al. Clin Microbiol Infect 2020; 26(12): 1622–9
4 Pritchard M et al. International Severe Acute Respiratory and Emerging Infections Consortium, COVID-19 Report, 8 June 2020: www.researchgate.net/publication/343217999_ISARIC_COVID-19_Clinical_Data_Report_8_June_2020; letzter Abruf: 4.10.2022
5 Hsu J. BMJ. 2020; 369: m1983
6 Barmer Krankenhausreport 2021 – Anhaltend hohe Klinikinfektionen während Pandemie: www.barmer.de/presse/infothek/studien-und-reporte/kranken-
hausreport/krankenhausreport-2021-1059516; letzter Abruf: 4.10.2022
7 Patel B et al. Infect Prev Pract. 2020; 2(3): 100089
8 Hübner C et al. Antimicrob Resist Infect Control 2015; 4: 50
9 CDC. Antibiotic Resistance Threats in the United States 2019: www.cdc.gov/drugresistance/biggest-threats.html; letzter Abruf: 4.10.2022
10 WHO Global Tuberculosis Report 2019: www.who.int/teams/global-tuberculosis-programme/tb-reports; letzter Abruf: 4.10.2022
11 Cassini A et al. Lancet Infect Dis 2019; 19(1): 56–66
12 Casari E et al. Antimicrob Resist Infect Control 2018; 7: 40
13 Corless C et al. Infect Prev Pract 2020; 2(3): 100011