Bei einem kritisch kranken Intensivpatienten müssen die Immunantworten auf eine schwere Infektion im Gewebe und im Blut nicht immer simultan und gleichartig ablaufen. Ein typisches, oft beschriebenes Bild: Es geschieht eine Immunsuppression und gleichzeitig eine Inflammation. Folglich muss über eine Therapie nachgedacht werden, die beide Prozesse gleichzeitig behandeln kann. Die Praxisrelevanz neuer Erkenntnisse aus der Immunologie wurde auf einem Satellitensymposium anlässlich des DIVI22 diskutiert.
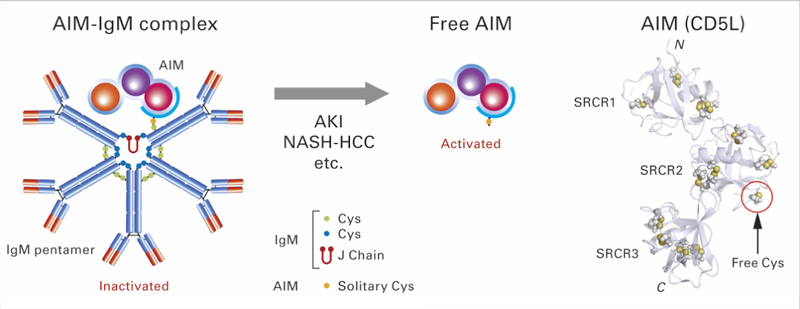
In unserem Immunsystem gibt es zwei Arten von B-Zellen, die Antikörper produzieren1, referierte Dr. Ulrich Bosch dos Santos, Pharmakologe und Biochemiker der Biotest AG. Die B2-Zellen produzieren die Pathogen-assoziierten Immunglobuline M (IgM). Die B1-Zellen erzeugen natürliche Antikörper, die zu 90% vom IgM-Typ, zu 10% vom IgA-Typ und nur in Spuren vom IgG-Typ sind. ‚Natürliche‘ Antikörper, entstehen ohne vorherigen Kontakt zu Fremdantigenen z.B. Erregern. Sie haben eine immunregulatorische Funktion. Mit der Kryo-Elektronenmikroskopie konnte u. a. fotografisch gezeigt werden, dass die große Mehrheit der natürlichen IgM(nIgM)-Moleküle, etwa so viele wie von den B1-Zellen stammen, eine Pentamer-Struktur mit einer Lücke aufweisen (Abb. 1).3 Die Lücke von nIgM ist spezifisch für das Protein CD5L (syn. AIM).2 So ist nIgM ein spezifischer Carrier für dieses Protein2, so der Pharmakologe. Demgegenüber besitzen die restlichen IgM eine Hexamer-Struktur.
AIM (CDL5) ist an einem breiten Spektrum biologischer Mechanismen beteiligt
Die Hauptaufgabe des Proteins ist, die von Pathogenen induzierte Apoptose der Makrophagen zu verhindern4, berichtete der Pharmakologe. Deshalb heiße das Protein CD5L in einer anderen Nomenklatur auch Apoptose Inhibitor Makrophagen (AIM). Darüber hinaus reguliert AIM auch die Inflammationsprozesse. So transformiert AIM auch die proinflammatorischen, Pathogen eliminierenden, gewebeschädigenden M1 Makrophagen hin zu den antiinflammatorischen, immunosuppressiven M2 Makrophagen, die für (Wund)Heilungsprozesse wichtig sind.5
Als kleines Molekül wird AIM sehr rasch renal eliminiert. Im Humanblut beträgt die Halbwertszeit von AIM 2–5 Stunden. AIM kommt daher im Blut nur inaktiv an nIgM gebunden vor (Abb. 2).3 Die maximale Serumkonzentration von nIgM und damit auch von AIM findet sich im Menschenalter von rund 20 Jahren und nimmt assoziiert zur Abnahme der B1-Zellen mit zunehmendem Lebensalter ab. AIM tritt normalerweise verstärkt als Folge einer Infektion oder Inflammation auf. Es wird von Makrophagen und Epithelzellen in Lunge oder Darm gebildet.6 Nach Abwendung einer Infektion wirkt AIM als ein molekularer Schalter zwischen der nötigen Inflammation, falls ein Schutz vor Pathogenen notwendig ist, und den antiinflammatorischen Heilungsprozessen.7 Ferner ist vom AIM bekannt, dass es mit der Proliferation von B-Zellen und TH17-Zellen assoziiert ist.8
Die TH17-Zellen wiederum produzieren das Interleukin IL-17 und regulieren so die Clearence von extrazellulären Pathogenen.9 AIM wirkt wie ein Schalter: Der Verlust von AIM wandelt nicht-pathogene TH17-Zellen in pathogene Zellen um.9
Immunstimulation durch IgM/AIM(CD5L)-Komplex
Im Mausmodell wirkt die Gabe von dem IgM/AIM-Komplex auf Makrophagen, Monozyten und dendritische Zellen (DC). Dies erhöht die Sekretion des Zytokins IL-10, das die Produktion von inflammatorischen Zytokinen hemmt.10–12 Es stimuliert zudem die Produktion des B-Zell aktivierenden Faktors (BAFF), einen Schlüsselfaktor für das Überleben peripherer B-Zellen.10, 11 Die resultierende B-Zell-Aktivierung führt zur Bildung von nIgM und IgA.11 Falls IgA nicht an einem Pathogen gebunden ist, wirkt es anti-inflammatorisch. „Wir haben hier Feed-back-Regulierungsmechanismen“, konstatierte Bosch dos Santos.
IgM/AIM-Komplex zeigte positive klinische Effekte
Dass die Gabe des IgM/AIM-Komplexes nicht nur im Tiermodell wirkt, untermauert Prof. Sakka mit einem Fallbericht. Eine Patientin mit einer Autoimmunerkrankung bekam vor 3 Monaten präoperativ eine Rituximab-Therapie. Infolgedessen waren danach B-Zellen und Immunglobulin-Spiegel im Serum deutlich erniedrigt.13 Durch die Infusion von polyvalentem IgGAM (Pentaglobin® mit angereichertem IgA und IgM) konnte sich das Immunsystem wieder nachhaltig normalisieren. Die Präparation IgGAM enthält den funktionell intakten IgM/AIM-Komplex, ergänzte Bosch dos Santos.
Ebenso konnte das Team um Prof. Dr. Michael Adamzik, Universitätsklinikum Knappschaftskrankenhaus Bochum, in einer COVID-19-Kohorte (n = 52) und auch bei ICU-Patienten mit Sepsis (n = 94) nachweisen, dass ein erhöhter AIM-Spiegel hoch signifikant mit positiven Effekten auf das 30-Tage-Überleben assoziiert ist: 70–80 % Überleben bei erhöhtem AIM-Level.14 Total-AIM scheint also auch beim Menschen ein entscheidender Überlebensfaktor bei kritischen Infektionen zu sein, schloss der Referent.
DER DARM ALS MOTOR DES MULTIORGANVERSAGENS
Der Darm kann eine systemische Inflammation verstärken und ist oft Ursache für eine endogene Infektion. Laut Prof. Adamzik stammen etwa 50% der nosokomialen Infektionen aus dem Gastrointestinaltrakt. Der Darm kann nicht nur ein Multiorganversagen erheblich verschlimmern, sondern es auch auslösen. Tritt bei Intensivpatienten durch die Translokation von Darmbakterien ins Peritoneum eine primäre Peritonitis auf, ergibt sich eine um 30% höhere Sterbewahrscheinlichkeit im Vergleich zu Patienten, die keine Symptomatik aufweisen.15 Darmbakterien können auch über das Lymphsystem oder direkt in die Blutstrombahn gelangen und schwerste Bakteriämien verursachen, erläuterte der Intensivmediziner.
Intestinaler Organ-Crosstalk
Adamzik besprach detailliert den Aufbau und die immuologischen Prozesse des Darmepithels. Auf ca. 400m² Epithel siedeln mit tausenden unterschiedlichen Spezies 80 Billionen Bakterien.16 Das Mikrobiom stellt dem Wirt z. B. zur Nahrungsaufnahme, zum Toxinabbau, zur Immunmodulation und zur Abwehr von pathogenen Mikroorganismen entscheidende Mechanismen bereit. Im darmassoziierten lymphatischen Gewebe (GALT), das sich im Epithel des Gastrointestinaltraktes befindet, werden etwa 80% der lymphoiden Zellen – dendritische Zellen (DC), B-, T-Zellen, Monozyten sowie Makrophagen – geparkt und erfüllen dort wichtige Funktionen.16
Das Mikrobiom steht physiologisch und über die DC im Epithel im engen Kontakt mit dem GALT. Veränderungen wie z. B. ein Schlaganfall, lokale Infektion, Traumata können dazu führen, dass die T-Zellen, die permanent den Körper auf der Suche inflammatorischer Situationen durchstreifen, aktiviert in den Darm zu den CD40- und CD80-Rezeptoren kommen.16 Die DC reagieren dann nicht mehr tolerant, sondern mit dem Mikrobiom inflammatorisch.17 Entscheidend ist dabei, dass dadurch Darmkeime ihr Virulenzverhalten verändern. Normalerweise harmlose Darmbakterien (z. B. E. coli) werden aggressiv und schütten Toxine aus.16
Zudem führt jede Schädigung der intestinalen Mukosa zu einer Störung der Barrierefunktion sowie zur Erhöhung der Epithelpermeabilität und begünstigt die pathologische Keimtranslokation.18 Infolgedessen führt ein Darmversagen auch zu einer Störung anderer Organsysteme (intestinaler Crosstalk).19
Was tun, wenn der Darm undicht wird?
Um bei einem gastrointestinalen Versagen (GIF) eingreifen zu können, müsse man die brisante Situation frühzeitig erkennen, betonte Adamzik. Er verwies dazu auf Biomarker, die in der Gastroenterologie bekannt sind, und den GIF-Score.20 Eine Arbeit hat gezeigt, dass man mit Messung des gastrointestinalen Reflux und des ständigen Prüfens des intraabdominellen Drucks (IAP) zur frühen Diagnose kommen kann.20
Ein persistierender oder wiederholter IAP über 12mmHg wird als intraabdominelle Hypertension (IAH) bezeichnet und ist schlecht für den Darm. Mit steigendem IAH werden Motilität, mukosal-mikrovaskuläre Durchblutung und Lymphabfluss beeinträchtigt. Das verursacht Dysbiose, Hyperpermeabilität und Translokation. GALT wird behindert bis zur GALT-Paralyse. Dem sollte man laut Adamzik mit der Vermeidung von Hypervolämie, Perfusionsförderung und Dekompressionsmaßnahmen begegnen. Bei einer IAP-Steigerung über 20mmHg müsse dem lebensbedrohlichen abdominellen Kompartmentsyndrom mit einer Intervention begegnet werden.
„Es gibt keine Daten dazu, wie man den undichten Darm wieder dichten kann“, bedauerte Adamzik. Wichtig seien eine adäquate enterale Ernährung sowie frühzeitige Maßnahmen zur Aufrechterhaltung der Motilität und zur Unterbindung von Hyperbulimie. Außer Stressreduktion, weniger Volumen und Vermeiden von bestimmten Substanzen (Antibiotika, PPI, Katecholamine, Opioide etc.), die GIF fördern können, gäbe es nichts, was derzeit empfohlen werden könne.
Da der IgM/AIM-Komplex auf Monozyten, Makrophagen und DC wirkt sowie TH17-Zellen, ergibt sich vielleicht die Möglichkeit, die von den inflammatorischen CD40, CD80 getriggerten TH1-, TH2- und TH17-Zellen zu modulieren, hofft Adamzik. Erste Daten seines Teams zeigen bereits, dass sich assoziiert mit dem GIF-Score Gaben vom IgM/AIM-Komplex bei Intensivpatienten mit Sepsis oder COVID-19 positiv auf das Überleben auswirken.14 Derzeit läuft durch unter der Leitung von Prof. Gernot Marx, RWTH Aachen, die multizentrische PEPPER*-Studie an, die die individualisierte Therapie mit IgGAM (Pentaglobin®) bei Peritonitis untersucht.
INFEKTION UND GERINNUNG: EIN UNHEILVOLLES DUO
PD Dr. med Richard Strauß, Uniklinikum Erlangen, stellte die weltweite randomisiert-kontrollierte PROWESS**-Multicenterstudie vor, die Daten zum Gerinnungsprofil von 1.690 Sepsis-Patienten erhoben hat.21 Demnach wiesen bei Aufnahme fast alle Veränderungen bzgl. der Gerinnung auf. So waren der inflammatorische Marker IL-6 bei fast 99% und der Quickwert bei 93% der Fälle angestiegen.21 Die prokoagulatorische Aktivität war bei den meisten Patienten bereits erhöht, die antikoagulatorische Aktivität erniedrigt.21 Ferner waren bei über 72% der Patienten die endothelialen Öberflächen mehr oder weniger geschädigt.21 „Wir sehen also generell bei schweren Infektionen gleichzeitig zu der Inflammation eine Aktivierung des Gerinnungssystems“, kommentierte der Intensivmediziner.
Infektions- bzw. Sepsis-induzierte Koagulopathie
Inflammation und Gerinnung gehören evolutionsbedingt zu einem einheitlichen System der biologischen Stressabwehr. Der Körper versucht Infektionen und einen Schaden lokal zu begrenzen. Gelingt das nicht und die Auswirkungen werden systemisch, greifen die Kompensationsmechanismen nicht mehr. Es kommt zur Immunothrombose.22 Solange diese lokal stattfindet, ist es im biologischen Sinne nützlich. Neben einigen anderen Faktoren spielen Mikrovesikel (MV) eine große Rolle im Fortleiten der Informationen Inflammation oder Prokoagulation.22
Laut Strauß moduliert nIgM die MV-induzierte Gerinnung über Bindung an oxidationsspezifische Epitope (OSE), die Inflammation und Gerinnung triggern können. nIgM vermag also die MV-induzierte Gerinnselbildung z. B. in der pulmonalen Strombahn verhindern (Tiermodell).23 Die neue Erkenntnis: Auch Entzündung und Gerinnung sind über die Immunglobuline miteinander verknüpft.
Falls eine Infektion eine systemische, d. h. nicht mehr lokal begrenzte, Entzündungs- und Gerinnungsaktivierung auslöst, kommt es zur disseminierten Fibrindeposition in den mikrovaskulären Blutbahnen23, so Strauß. Länger anhaltende Aktivierungen führen zu einem ausgeprägten Verlust der Hämotasekompetenz, sodass es nach der Bildung unzähliger kleiner Thromben zu unkontrollierten Blutungen kommen kann, die z. B. als Hämorrhagien der Haut sichtbar werden.
COVID-19-assoziierte Koagulopathie
Aus Lungenschnitten von COVID-19-Verstorbenen wurden ausgeprägte mikrovaskuläre Thrombosierungen nachgewiesen. SARS-CoV-2 infiziert u. a. Pneumozyten, Makrophagen und Endothelzellen. Es induziert prothrombogene Veränderungen auch in Organen fern der Lunge.24 Hierzu zeigt eine Registerstudie aus Skandinavien, dass Intensivpatienten mit COVID-19 ein 30-fach erhöhtes Risiko für Thrombosen in den tiefen Beinvenen und ein fast 300-fach erhöhtes für Lungenembolien haben.25 Diese erhöhten Risiken bestehen ungefähr 120 Tage, für arterielle Verschlussfolgen, wie z. B. Herzinfarkt und Schlaganfall, noch länger.24
Therapieoptionen
In einer großen US-amerikanischen Registerstudie (retrospektive MIMIC-III-Datenbankanalyse mit 50.000 ICU-Patienten) hatten Patienten mit Sepsis-assoziierter Koagulopathie eine deutlich bessere Überlebensprognose mit unfraktioniertem Heparin (UFH) in prophylaktischer oder therapeutischer Dosierung als jene, die kein Heparin bekommen haben.26 Im Verlauf der Corona-Pandemie fand man heraus, dass die prophylaktische Antikoagulation mit UFH die Prognose der COVID-19-assoziierten Koagulopathie verbessert.27 In der REMAP-CAP***-Studie konnten Intensivpatienten gegenüber der prophylaktischen Gabe von UFH durch eine therapeutische oder intermediär intensivere Antikoagulation nicht zusätzlich profitieren.28 Nach Strauß’ bringt die Therapie mit Clopidogrel oder Ticagrelor oder ASS im Akutstadium nach derzeitigem Kenntnisstand keinen Nutzen.29
Pragmatische Schlussfolgerung
Aus der Verknüpfung von Inflammation und Koagulopathie ergibt sich für Patienten mit ernsten Infektionen ein erhöhtes Risiko für Makro- und Mikrothrombosen. Im Moment gibt es keine etablierte spezifische Therapie der sepsis-asoziierten Koagulopathie. Deshalb muss die adäquate Behandlung der Grunderkrankung bzw. Infektion die Basis sein, konstatierte Strauß. Bei der septischen Koagulopathie sei eine prophylaktische Antikoagulation sinnvoll. Liegt eine manifeste Thromboembolie vor, die bei COVID-19-Erkrankungen oft auftritt, wird eine therapeutische Antikoagulation notwendig. Bei manifester Blutung brauche es entsprechende Maßnahmen wie die Gabe von (Gerinnungs-)Faktoren und Thrombozyten.
ÜBER DEN IMMUNSTATUS VON INTENSIVPATIENTEN
Die Sepsis ist nach wie vor die Haupttodesursache auf Intensivstationen, stellte Prof. Detlef Kindgen-Milles, Universitätsklinikum Düsseldorf, fest. Gegenüber früher habe sich der Phasenverlauf geändert. Während früher Sepsis-Patienten in der Frühphase verstorben sind, überleben heute die weitaus meisten Patienten einer septischen Infektion die ersten 36 Stunden29 – ein Erfolg der Umsetzung der Sepsis-Leitlinien.30 Jedoch trotz noch so guter Antibiotikatherapie, Beatmung, hämodynamischer Stabilisierung und Optimierung der Nierenersatzbehandlung, wenn ein immunologisches Problem nicht erkannt wird, werden diese Patienten nach langen Verlauf doch noch sterben. Nur sehen Klinikärzte es oft nicht mehr, denn nach überstandener Sepsis gibt es auch noch nach Jahren eine Übersterblichkeit.29 Der plötzlich auftretende Herpes, die Pneumonie, die Pilzinfektion, die sekundär kurz nach überstandener Infektion oder Operation in der abdominalen oder Herzchirurgie auftreten, sind deutliche Zeichen einer Immun-Inkompetenz.30
Differenzial-Blutbild zum Monitoring des Immunstatus
Es gibt außerhalb der Universitätskliniken nur wenig Überwachungsmöglichkeiten einer immunologischen Inkompetenz. Doch der Verlauf des Differenzial-Blutbildes ist eine wichtige Steuerungsgröße. Die Mehrzahl der Intensivpatienten hat bereits initial eine Lymphozytopenie.32 Wird das Blutbild verfolgt, ist eine Gruppe zu erkennen, bei der die Lymphozytenzahl wieder schnell steigt. Diese Intensivpatienten streben relativ komplikationsarm rasch ihrer Entlassung entgegen. Die Gruppe mit persistierender Lymphopenie erleiden Sekundärinfektionen und Komplikationen. Das ist die Gruppe mit der höchsten Letalität.33
HLA-DR-Expressionskinetik und Outcome
Die HLA-DR Expression auf Monozyten ist ein gut untersuchter Oberflächenmarker, der eine lang anhaltende Immunsuppression anzeigt. Der Parameter ist allerdings in vielen Krankenhäusern nicht messbar.32 In einer Studie mit 241 Patienten mit septischem Schock, unterschiedlichen Erregern und Infektionsfoci erwies sich die HLA-DR Expression als unabhängig von Infektionsort oder Erreger.34 Die Patienten mit anhaltend niedrigem HLA-DR-Status haben ein schlechtes Outcome. Patienten mit initial niedrigen Werten, bei denen sich die Expression wieder normalisiert, haben eine gute Prognose, resümierte Kindgen-Milles.
IgM-Serumspiegel bei Sepsis
Er empfiehlt, zusätzlich die Immunglobulin-Spiegel zu messen. nIgM sei das erste Immunglobulin, das als Reaktion auf eine Infektion produziert wird. Viele Arbeiten, auch in großen Kohortenstudien geben klare Hinweise: Mit der Höhe der IgM-Spiegel kann differenziert werden, welcher Sepsis-Patient überleben wird oder wie hoch das Letalitätsrisiko ist.35
Kann eine IgM- Substitution helfen?
Dazu gibt es die gute prospektive, randomisierte CIGMA-Studie mit stationär aufgenommenen Patienten (n = 160) mit ambulant erworbener schwerer Pneumonie (CAP).36 Solche Patienten haben ein Sterblichkeitsrisiko von ca. 30%. Es ging um die Applikation einer IgM-angereicherten Immunglobulinlösung (Trimodulin, 42mg/kg/d für 5d vs. Placebo). Für die Gesamtgruppe ergibt sich gegenüber Placebo kein Unterschied. Für die Subgruppe mit niedrigem IgM-Spiegel (IgM < 0,8 g/L; n = 111) zu Infektionsbeginn bewirkte jedoch die IgM-Sustitution eine deutliche, statistisch signifikante Reduktion der Sterblichkeit. Ähnliches zeigte die Gruppe mit starker Inflammation (CRP > 70mg/L; n = 124). Die Subgruppe, die beide Kriterien erfüllte, hatte versus Placebo zahlenmäßig die größte Letalitätsreduktion.
Resümee
Die CIGMA-Studie zeigt also, dass es keinen Sinn macht, jedem Sepsis-Patienten ein Immunglobulin zu geben. Jedoch mit indikationsgerechter IgM-Substitution – niedriger IGM-Spiegel, starke Inflammation – kann die Sterblichkeit verringert werden. So wird aus Kindgen-Milles‘ Sicht daraus ein Konzept.
Außerdem reiche es nicht, die Immunglobulinlösung zu infundieren. Sie müsse auch so hoch dosiert werden, dass es zu einer messbaren Erhöhung des Spiegels kommt.
(mk)
Quelle:
Satellitensymposium „Infektion und Inflammation bei kritisch kranken Patienten auf der ICU – was sollten wir wissen?“ anlässlich des DIVI 2022, Hamburg, 05.12.2022.Sponsor: Biotest AG. In Kooperation mit der Biotest AG
_______
* Personalisierte Medizin mit IgGAM im Vergleich zum Behandlungsstandard bei der Behandlung von Peritonitis nach Kontrolle der Infektionsquelle (die PEPPER-Studie)
** Recombinant Human Activated Protein C Worldwide Evaluation in Severe Sepsis
*** Randomized Embedded Multifactorial Adaptive Platform for Community-acquired Pneumonia
1 Michaud E, Mastrandrea C et al, Trends in Immunol. 2019; 41(2): 141–56. DOI: 10.1016/j.it.2019.12.005
2 Gong S, Ruprecht RM. Front Immunol. 2020; 11: 1943. DOI: 10.3389/fimmu.2020.01943
3 Arai S, Miyazaki T. Seminars Immunopathol. 2018; 40: 567–75. DOI: 10.1007/s00281-018-0717-6
4 Valledor AF, Hsu LC et al. PNAS 2004; 101(5). DOI: 10.1073pnas.0407749101
5 Sanjurjo L, Aran G et al. Front Immunol. 2018; 9. DOI: 10.3389/fimmu.2018.00480]
6 Hiramoto E, Tsutsumi A et al. Sci Adv. 2018; 4(10). DOI: 10.1126/sciadv.aau1199
7 Kiamura H, Suzuki M et al. J Immunol 2017; 199: 3870-82
8 Lai X, Xiang Y et al. Int Immunopharmacol 2018; 63: 311-6
9 Wang C, Yosef N et al. Cell 2015; 163(6): 1413–27. DOI: 10.1016/j.cell.2015.10.068
10 Mackay F, Browning JL. Nat. Rev Immunol 2002; 2: 465–75 DOI:10.1038/nri844
11 Vaschetto R, Clemente N et al. Immunobiol 2017; 222(12): 1074–80. DOI: 10.1016/j.imbio.2017.09.002
12 Wilson CS, Chhabra P et al. Diabetes 2018; 67(11): 2349–60. DOI: 10.2337/db18-0456
13 Sakka SG. Anästh Intensivmed 2021; 62: 82–85. DOI: 10.19224/ai2021.082
14 Ziehe D et al., HAI Congress 2022 [Publikation in Vorbereitung]
15 Reintam BA, Poeze M et al. Intensive Care Med 2013; 39: 899–909
16 Mittal M, Coppersmith CM. Trends Mol Med 2014 April; 20(4): 214–23
17 Valeri M, Rossi S et al. PLOS ONE 2015; DOI: 10.1371/journal.pone.0117486
18 König J, Wells et al. Clin Transl Gastroenterol. 2016; 7: e196. DOI: 10.1038/ctg.2016.54
19 Chen Z, Venkat P et al. Circ Res. 2017; 121(4): 451-68
20 Reintam A, Parm P et al. Crit Care. 2008; 12(4): R90
21 Kinasewitz GT, Yan SB et al. Crit Care 2004; 8: R82–R90. DOI: 10.1186/cc2459
22 Iba T, Levi M et al. Semin Thromb Hemost. 2020; 46(1): 89–95. DOI: 10.1055/s-0039-1694995
23 Obermayer G, Afonyushkin T et al. Blood 2021; 137(10): 1406–15. DOI: 10.1182/blood.2020007155
24 O’Sullivan et al. Lancet Haematol 2020; 7(8): e553-e555
25 Katsoularis I, Fonseca-Rodriguez O et al. BMJ 2022; 376: e069590
26 Peng JC, Nie F et al. Front Med 2022; 8: 773339. DOI: 10.3389/fmed.2021.773339
27 REMAP-CAP Writing Commitee and ACTIV-4a Investigators. N Engl J Med 2021; 385: 777–89. DOI: 10.1056/NEJMoa2103417
28 REMAP-CAP Writing Commitee, JAMA 2022; 327(13): 1247–59. DOI: 10.1001/jama.2022.2910
29 Delano Mj Ward PA. Immunol Rewiews 2016; 274: 330–53
30 Evans L, Rhodes A et al. Surviving sepsis compaign:… Intensive Care Med 2021; 47: 1181–247. DOI: 10.1097/CCM.0000000000005337]
31 Pfortmueller CA, Meisel C et al. Intensive Care Med Exper 2017; 5: 49
32 Stortz JA, Murphy TJ et al. Shock 2018; 49(3): 249–58
33 Drewry AM,Samra N et al. Shock 2014; 42(5): 383–91
34 Leitje PG, Rimmele Tet al. Critical Care 2020; 24: 11
35 Bermejo-Martin JF, Rodriguez-Fernandez A et al. J Intern Med 2014; 276: 404. DOI: 10.1111/joim.12265
36 Welte T, Dellinger RP et al. Intensiv Care Med 2018; 44: 438