„Wir gehen aktuell einen Schritt in der COVID-19-Therapie, der richtungsweisend ist, nämlich hin zu einer zielgerichteten, Biomarker-stratifizierten Behandlung“, führte Prof. Dr. Tobias Welte, Hannover, in die Thematik ein. Wie man durch rechtzeitigen Einsatz des Interleukin(IL)-1-Rezeptorantagonisten Anakinra bei SARS-CoV-2Infektion ein Abgleiten in die Intensivpflichtigkeit verhindern kann, zeigt die SAVE-MORE-Studie. Dabei können mit Hilfe des Biomarkers suPAR (löslicher Urokinase-Plasminogen-Aktivator-Rezeptor) frühzeitig die Risikopatienten identifiziert werden, die von der Immunmodulation profitieren können. Das Risiko für schwere Verläufe und/oder Tod wurde um die Hälfte gesenkt. Im Dezember 2021 erhielt Anakinra (Kineret®) eine entsprechende Zulassung zur Behandlung von Patienten mit COVID-19-Pneumonie.
Bei Intensivpatienten mit COVID-19 treten hohe Spiegel von proinflammatorischen Zytokinen auf, welche letztlich die Ursache für einen schweren Verlauf mit Beatmungspflichtigkeit darstellent1, berichtete Welte über eigene Daten. Die Besonderheit bei schweren Infektionen mit SARS-CoV-2 sei, dass die auftretende Inflammation nicht endet, sondern selbsterhaltend in mehreren Wellen mit hoher Intensität auftreten kann. Insofern sei es primäres Therapieziel bei COVID-19, ein Fortschreiten in die kritische, hyperinflammatorische Phase zu verhindern.2
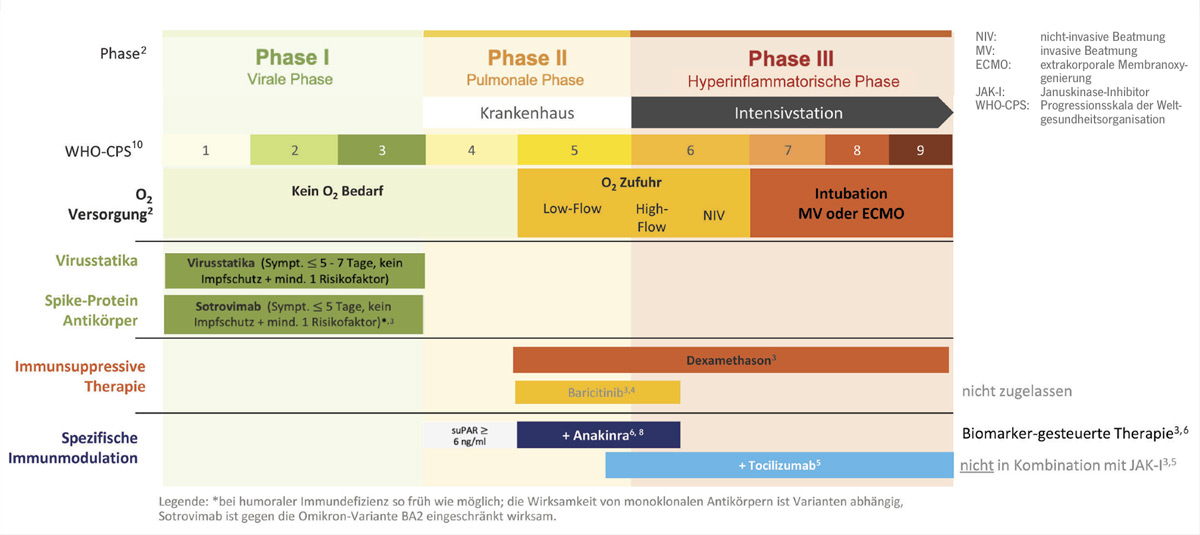
Überblick phasenspezifische Behandlung
Welte gab einen Überblick: Es sollten leitliniengemäß phasenadaptiert verschiedene therapeutische Targets adressiert werden (Abb. 1).3 In der frühen, viralen Phase können Virustatika und Spikeprotein-neutralisierende, monoklonale Antikörper eingesetzt werden.3 Wobei bei den Antikörpern inzwischen nur noch für Sotrovimab eine Wirksamkeit bei den Omikron-Varianten gegeben ist.3 Ab der pulmonalen Phase ist eine immunsuppressive Behandlung mit Dexamethason mittlerweile Standard, die durch eine immunmodulatorische Anti-Zytokintherapie je nach Sauerstoffbedarf und/oder Risikostratifizierung intensiviert werden kann (Abb. 1).3 So sollte jeder Patient im Krankenhaus mit COVID-19-Pneumonie und Sauerstoffbedarf Steroide bekommen.3 Für nicht sauerstoffpflichtige Patienten wird das nicht empfohlen. Zusätzlich kann bei Patienten unter LowFlow-, oder High-Flow-Sauerstofftherapie der Januskinase(JAK)-Inhibitor Baricitinib verabreicht werden, der günstige Effekte auf den Krankheitsverlauf bei Patienten mit moderater bis schwerer COVID-19-Pneumonie zeigte, aber bisher noch nicht zugelassen ist.3, 4 Patienten mit rasch zunehmenden Sauerstoffbedarf bis hin zum respirato rischen Versagen können von einer Therapie mit dem IL-6-Antagonisten Tocili zumab profitieren 3, 5, so Welte.
Welte betonte, dass nun für Patienten mit sauerstoffpflichtiger COVID19-Pneumonie und Progressionsrisiko, das mittels Serumspiegel ≥ 6ng/ml der löslichen Form des Urokinase-Plasminogen-AktivatorRezeptors (suPAR) bestimmt wurde, eine Anti-IL1-Therapie mit Anakinra als ergänzende, wichtige Therapieoption zur Verfügung steht (Abb. 1). Der „personalisierte“, Biomarker-geführte (suPAR ≥ 6ng/ml) Einsatz von Anakinra zielt darauf, den Übergang von der pulmonalen in die kritische, hyperinflammatorische Phase zu verhindern.6
Spezifische immunmodulatorische
Therapie mit Anakinra SARS-CoV-2 kann epitheliale und endotheliale Zellen schädigen, die dann sog. Alarmine wie IL-1α freisetzen, erklärte der Rheumatologe Prof. Dr. Gerd R. Burmester, Charité Berlin. Ins geschädigte Gewebe eingewanderte Makrophagen produzieren dann z. B. IL-1β, IL-6 sowie andere Inflammationsmediatoren.7 Es resultiert bei schwerem COVID19-Verlauf eine frühe IL-1-getriebene autoinflammatorische Kaskade.
Eine frühe Blockade insbesondere von IL-1α noch in der pulmonalen Phase mit Anakinra kann die unspezifische, exzessive Inflammationsreaktion abschwächen und so bei Patienten mit COVID-19Pneumonie die Entwicklung eines akuten Atemnotsyndroms (ARDS) verhindern.6
Anakinra ist die rekombinante Form des endogenen, humanen IL-1 Rezeptorantagonisten (IL-1 RA).8, 9 Es hemmt kompetitiv IL-1α und IL-1β durch Bindung an den IL-1-Rezeptor, der in vielen Geweben und Organen exprimiert wird, wodurch es
- die überschießende IL-1-induzierte Immunantwort dämpft,
- effektiv die Produktion von Entzündungsparametern, z. B. IL-6, Prostaglandin E2 (PGE2), C-reaktives Protein (CRP), senkt und
- i. d. R. schnell klinische Entzündungszeichen, z. B. Schwellung und Fieber, bessert.
Bei COVID-19-Pneumonie wird risikoadaptiert eine Fertigspritze Anakinra 100mg einmal täglich s.c. für bis zu 10 Tage verabreicht. Die maximale Plasmakonzentration wird nach 3–7 Stunden erreicht.8 Bei einer Bioverfügbarkeit von 95% nach einer s.c. Injektion liegt die Halbwertszeit bei kurzen 4–6 Stunden.8 „Anakinra wirkt schnell und ist gut steuerbar. Es hat ein günstiges und bereits aus der Rheumatologie gut dokumentiertes Sicherheitsprofil“, unterstrich Burmester.
Die Patientenauswahl und das „Timing“ sind wichtig
Das Progressionsrisiko ist nicht bei allen Patienten gleich ausgeprägt. Um die richtigen Patienten und das Zeitfenster einer frühen Immun aktivierung zu erkennen, können Biomarker wie suPAR helfen, erklärte der Intensivmediziner Prof. Dr. Michael Bauer, Universitätsklinikum Jena. Ein früher Anstieg des suPAR-Plasmaspiegels scheint auf eine übermäßige Freisetzung von Alarminen wie z. B. IL-1α hinzuweisen.6
Bauer erläuterte das SAVE-MORE-Studienprogramm. In der randomi sierten, placebo-kontrollierten, doppelblinden SAVE-MORE-Studie wurden 1.060 erwachsene Patienten mit frühen Zeichen einer COVID-19Pneumonie in der Bildgebung gescreent und als Einschlusskriterium der Plasmaspiegel des Risiko-Biomarkers suPAR herangezogen.6 Die meisten Patienten benötigten zwar Low- oder High-Flow-Sauerstoff, waren aber noch nicht beatmungspflichtig. 594 dieser Patienten konnten trotz lediglich moderat erhöhter Entzündungsparametern (CRP, Ferritin, IL-6) mit dem suPAR-Wert ≥ 6ng/ml als Hoch-RisikoKollektiv identifiziert werden und erhielten frühzeitig zusätzlich zur Standardtherapie (SOC – Dexamethason, Remdesivir, Antikoagulation) über 10 Tage entweder 1x täglich subkutan Anakinra oder Placebo.
Halbiertes Risiko für schwere Verläufe
Insgesamt zeigte sich in SAVE-MORE unter Anakinra plus SOC im Vergleich zum Placeboarm, gemessen mit der 10-stufigen, klinischen Progressionsskala der Weltgesundheitsorganisation (WHO-CPS)10, eine deutlich signifikante Verbesserung des klinischen Outcomes an Tag 28:6
- Die Hälfte der Patienten mit Anakinra-Therapie war an Tag 28 vollständig genesen, gegenüber nur 26,5% bei Placebo-Therapie.
- Nur 6,3% zeigten unter Anakinra einen schweren Verlauf (WHOCPS ≥ 6) bzw. verstarben gegenüber 13,2% in der Placebo-Gruppe (Odds Ratio 0,46; p < 0.001).
- Die 28-Tage-Sterblichkeit reduzierte sich insgesamt um 55% (Hazard Ratio 0,45; p = 0,045).
Anakinra zeigte in der SAVE-MORE-Studie ein gutes Sicherheitsprofil: Es zeigten sich unter Anakinra weniger bakterielle Sekundärinfektionen und eine bessere Viruselimination als bei den Kontrollpatienten6, 9, so Bauer. Auch bei COVID-19-Patienten, bei denen Sekundärinfektionen auftreten, was bei SARS-CoV-2-Infektionen nicht selten vorkommt, könne die Behandlung mit Anakinra laut Fachinformation fortgeführt werden8, ergänzte Burmester.
Perspektive: Biomarker gestützte Sepsistherapie
Aktuell werden in Jena Sepsis-Patienten in die europaweite, multizen trische Studie ImmunoSEP11 eingeschlossen, berichtete Bauer. Diese Patienten erhalten auch bei bakteriell getriggerter Sepsis entweder bei Immunparalyse eine Immunstimulation mit Gamma-Interferon oder suPAR-geführt bei Hyperinflammation eine IL-1 Rezeptorblockade.
Fazit
Bei COVID-19-Pneumonie kann die rechtzeitige, risikoadaptierte Gabe des IL-1-Rezeptorantagonisten Anakinra dazu beitragen, die im Rahmen einer SARS-CoV-2-Infektion überschießende Immunreaktion und eine daraus resultierende Intensivpflichtigkeit und/oder den Tod zu verhindern. Dabei trägt der Biomarker suPAR nicht nur zur Differenzialdiagnose bei, sondern könne auch prädiktiv aussagen, ob ein Patient von der spezifischen Immunmodulation profitieren wird.
(mk)
Quelle: Symposium „Personalisierte Therapie bei COVID-19: Phasenspezifische und risiko adaptierte Immunmodulation“ anlässlich des 62. DGP-Kongresses, Leipzig, 27.05.2022. Sponsor: Swedish Orphan Biovitrum GmbH.
In Kooperation mit Swedish Orphan Biovitrum GmbH
1 Ruhl L et al. Signal Transduct Target Ther. 2021 Dec 10; 6(1): 418
2 Siddiqi HK, et al. J Heart Lung Transplant. 2020; 39(5): 405–7
3 Kluge S, Janssens U, Welte T et al. S3-Leitlinie Empfehlungen zur stationären Therapie von Patienten mit COVID-19, Stand: 28.02.2022, AWMF-Registernr. 113-001LG
4 RECOVERY Collaborative Group et al: Lancet. 2022 Jul 30; 400(10349): 359–68
5 Fachinformation RoActemra (Tocilizumab), Stand: 12/2021
6 Kyriazopoulou E, Poulakou G, Milionis H et al: Nat Med. 2021; 27(10): 1752–60
7 van de Veerdonk FL, Netea MG. Crit Care 2020; 24(1): 445
8 Fachinformation Kineret (Anakinra), Stand 7/2022
9 Cavalli R, Dinarello CA. Front Pharmacol 2018; 9: 1157
10 Lancet Infect Dis. 2020 Aug; 20(8): e192-e197
11 https://www.immunosep.eu; eingesehen am 12. September 2022