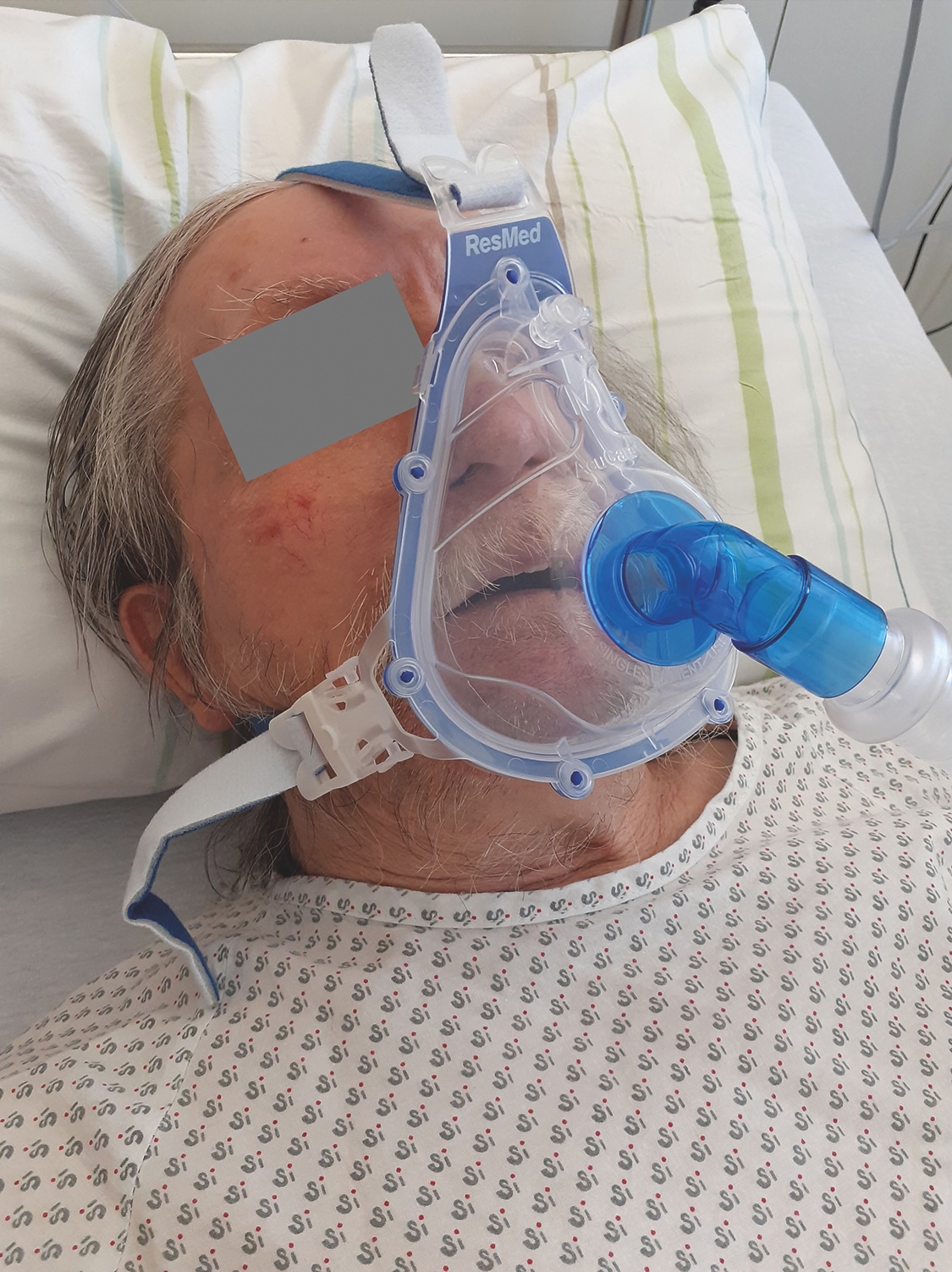
Das hyperkapnische Atmungsversagens ist Folge einer erschöpften Atempumpe und damit Ausdruck eines Ungleichgewichtes zwischen der muskulären Belastung und der muskulären Kapazität. Pathophysiologisch basiert diese Erschöpfung auf einer relativ erhöhten Atemarbeit in Bezug auf die Kraft und Ausdauer der Atemmuskulatur. Dabei wird zwischen der Hypoxie (= Parenchymversagen) und einem hyperkapnischen Versagen (= Atempumpeninsuffizienz) unterschieden. Die Therapie der ventilatorischen Insuffizienz, die als Störung der Sauerstoff (O2)-Aufnahme und der Kohlendioxid (CO2)-Abgabe definiert ist, erfordert primär die Behandlung der zugrunde liegenden Erkrankung. Eine darüber hinaus bestehende Hypoxie wird meist mit einer nasalen O2-Gabe und eine Hyperkapnie mit einer künstlichen Beatmung behandelt. Ziel der mechanischen Beatmung ist die CO2-Elimination mit Behandlung einer respiratorischen Azidose mit adäquater Oxigenierung, wobei in der akuten ventilatorischen Insuffizienz sowohl invasive als auch nicht-invasive Beatmungsformen (NIV) eingesetzt werden.1-3 COPD-Patienten mit einer chronischen hyperkapnischen ventilatorischen Insuffizienz können auch ambulant zu Hause mit einer NIV behandelt werden, die sie primär nachts aber auch im Wechsel mit Spontanatmung am Tage anwenden können. Die NIV-Applikation erfolgt in der Regel über eine Nasen-, Nasen-Mund-, Vollgesichtsmaske oder Mundstücke, von denen es unterschiedliche Größen gibt (Abb. 1). Heutzutage wird fast ausschließlich eine Positivdruckbeatmung (NPPV = non-invasive positive pressure ventilation) verwendet, während die Negativdruckbeatmung bei der COPD nur noch einen historischen Wert besitzt.
Indikation und Ziele der ambulanten NIV
Voraussetzungen zur Indikation einer elektiven NIV sind eine Atempumpeninsuffzienz, die eine potenzielle invasive Beatmungspflichtigkeit nach sich ziehen kann, Symptome einer ventilatorischen Insuffizienz, eine Hyperkapnie und die Bereitschaft des Patienten sich entsprechend therapieren zu lassen. Mindestens eines der folgenden Kriterien muss für die ambulante NIV-Therapie bei der COPD und anderen Erkrankungen mit einer chronischen hyperkapnischen respiratorischen Insuffizienz erfüllt sein:3
- Chronische Hyperkapnie mit PaCO2 > 50mmHg
- Nächtliche Hyperkapnie mit PaCO2 > 55mmHg
- Hyperkapnie während des Tages von PaCO2 56–50mmHg und einem PaCO2-Anstieg während des Schlafes um >10mmHg
- Persistierende Hyperkapnie mit PaCO2 > 53mmHg mindestens 2 Wochen nach einer akuten COPD-Exazerbation, die wegen einer respiratorischen Azidose eine mechanische Beatmung erforderte.
- Wenn eine Dekanulierung nach verlängerter Weaningphase nur mit Hilfe einer NIV möglich war und eine Langzeitüberwachung des Patienten auch nach Krankenhausentlassung notwendig ist.
- Entweder nach einer Exazerbation mit nachfolgender insuffizienter Erholung (persistierende Hyperkapnie) oder einer Hyperkapnie im chronischen, stabilen Erkrankungszustand.
- Dabei ist eine Kombination mit einer Langzeit-Sauerstofftherapie bei einer persistierenden Hypoxie (PaO2 < 55mmHg) möglich und empfohlen.4, 5
Ziel der häuslichen nicht-invasiven Beatmungstherapie ist via CO2-Elimination eine Verbesserung der Lebensqualität mit Verlängerung der Lebenszeit zu erzielen.6–8
Rationale einer NIV-Therapie bei hyperkapnischen COPD-Patienten
Die Wirkung der NIV bei der COPD ergibt sich aus den pathophysiologischen Faktoren, die zum Atmungsversagen führen. Die NIV antagonisiert den intrinsischen positiv-endexpiratorischen Druck (PEEPi) durch Einsatz eines externen PEEPs. Durch die zusätzliche maschinelle Druckunterstützung reduziert sich die diaphragmale Atemarbeit. Zusätzlich senkt der externe PEEP die zum Triggern der Druckunterstützung erforderliche inspiratorische Atemarbeit des Patienten.
Kontraindikationen und Abbruchkriterien
Absolute Kontraindikationen sind eine fehlende Spontanatmung und eine Schnappatmung, eine Verlegung der Atemwege, eine gastrointestinale Blutung oder ein Ileus. Relative Kontraindikationen sind eine ausgeprägte Agitation, ein bronchialer Sekretverhalt, eine respiratorische Azidose pH < 7,1 und eine schwergradige Hyperkapnie, eine hämodynamische Instabilität bzw. ein kardiogener Schock inkl. einem Mykoardinfarkt, kardiale Arrhythmien, eine Maskenintoleranz oder andere physische oder anatomische Gründe, die eine Maskenbeatmung substanziell erschweren (inkl. Operationen im oberen Gastrointestinaltrakt oder HNO-Bereich und eine Klaustrophobie.
Bei Erfolglosigkeit, definiert als persistierende oder sich verschlimmernde Azidose, Hyperkapnie, Hypoxie sowie eine fehlende klinische Besserung, muss statt der NIV eine invasive Beatmung eingeleitet werden.
Praktische Aspekte bei der NIV-Einleitung
NIV-Masken mit Luftauslassöffnungen (die das Abführen des ausgeatmeten CO2 über die Ausatemöffnungen der Masken erlauben) werden mit Geräten verwendet, die ein Leckageschlauchsystem erfordern. NIV-Masken ohne Luftauslassöffnungen werden dagegen mit Geräten verwendet, die über ein eingebautes Exspirationsventil im Schlauchsystem verfügen, oder die es den Patienten erlauben, durch den Exspirationsblock auszuatmen. Leckagen durch einen undichten Maskensitz stören nicht nur den Patienten durch den Luftfluss im Gesichtsbereich, sondern schränken die Beatmungseffektivität ein. Sie müssen vom Beatmungsgerät kompensiert werden. Eine weitere häufige Komplikation sind Druckstellen vor allem im Bereich des Nasenrückens bei zu strammen Maskensitz.
Wie eine Cochrane-Analyse belegt, profitieren nicht nur Patienten mit einer milden Azidose (pH zwischen 7,30 und 7,35) vom Einsatz der NIV, sondern in gleicher Weise auch Patienten mit einer respiratorischen Insuffizienz und schwerer Azidose (pH < 7,30), wenn die NIV im akuten Fall auf einer Intensiv- oder Intermediate Care Station eingesetzt wird. Patienten mit pH < 7,30 profitieren deutlich mehr hinsichtlich einer Verkürzung der stationären Aufenthaltsdauer als solche mit einer milderen Azidose.8
Empfehlungen zur NIV bei der akuten respiratorischen Insuffizienz
Bei der akuten COPD-Exazerbation mit einer akuten hyperkapnischen respiratorischen Insuffizienz soll die NIV ab einem pH < 7,35 eingesetzt werden, nachdem die o. g. Kontraindikationen ausgeschlossen wurden. Während der Adaptationsphase muss innerhalb von 30–60 Minuten eine Ersteinschätzung der Effektivität anhand von Blutgasen und klinischer Beurteilung erfolgen: Die validen Verlaufsparameter während der Adaptationsphase sind die Blutgaseanalyse (oder SaO2 mit transkutaner CO2-Messung), die Atemfrequenz, die Beurteilung der Dyspnoeempfindung sowie des Vigilanzniveaus des Patienten. Auf niedrigem Niveau stabile pH-Werte und ein stabil erhöhter PaCO2 sind während der NIV-Adaptation auch länger als 1–2 Stunden tolerabel, wenn sich der klinische Zustand des Patienten bessert. Auch nach zunächst erfolgreichem Einsatz der NIV können Patienten auch nach mehr als 7 Tagen ein „NIV-Spätversagen“ mit hyperkapnischem Atemversagen entwickeln, was mit einer hohen Letalität assoziiert ist.3 Bei NIV-Versagen bleibt nur noch die invasive Beatmung. Therapieeffektivität Patienten mit einer stabilen schweren COPD (FEV1 28% vom Sollwert) und einer respiratorischen Globalinsuffizienz (PaCO2 >7,7kPA oder 58mmHg), mit einem Body-Mass-Index von < 35 kg/m², die ungeachtet dessen im 6-Minuten-Gehtest mehr als 200m schaffen und die positiv auf eine NIV reagieren (PaCO2-Reduktion von > 20% oder unter 6,5kPA = 49mmHg) profitierten von einer nächtlichen Heimbeatmungstherapie. Unter diesen Voraussetzungen konnte sogar das Letalitätsriskiko gesenkt werden.7 Weitere Studien belegten die Überlegenheit der Beatmung mit dem Ziel der maximalen CO2-Reduktion bei COPD-Patienten. Die NIV erfolgte dabei in der Regel im kontrollierten Beatmungsmodus, wobei jedoch unklar bleibt, ob die Erhöhung der Inspirationsdrücke, die Erhöhung der Atemfrequenzen oder die Erhöhung beider Parameter wegweisend für den Therapieerfolg waren. Ein IPAP (inspiratoric positive airway) von über 20cmH2O führt zu einem signifikanten Absinken des PaCO2 und der COPD-Mortalität.6 Auch beim akuten Atemversagen hat die NIV in einer Fülle von wissenschaftlichen Publikationen bewiesene Vorteile, wie die Reduktion der Intubationshäufigkeit, Abnahme der nosokomialen Infektionen und deren Komplikationen.3
Therapiedauer der NIV
Es gibt nur begrenzte klinische Untersuchungen, bei welchen Kriterien eine NIV beendet werden kann oder muss. Dies hängt auch mit Unterschieden der verschiedenen, ein respiratorisches Atmungsversagen verursachenden Erkrankungen zusammen.9 Grundsätzlich kann die NIV beendet werden, wenn die akute Episode mit Normalisierung des pH überstanden ist, die Patienten eine nicht-assistierte Atmung auch bei noch erhöhtem pCO2 tolerieren und wenn die Blutgasanalyse auch ohne die Beatmung normal bleibt. Bei Patienten mit chronischer Hyperkapnie, bei denen nicht mit einer Normalisierung des pCO2 zu rechnen ist, sind entsprechende Vorbefunde bezüglich der Überleitung der akuten NIV-Therapie in eine außerklinische NIV zur Behandlung der chronisch ventilatorischen Insuffizienz zu berücksichtigen.3
Überleitung in die häusliche Versorgung
Eine häusliche NIV-Therapie, z. B. nach COPD-Exazerbation im Krankenhaus, erfordert diverse Voraussetzungen: Der Patient muss nach Anleitung mit der Beatmungsmaske, den Einstellungen der Parameter und dem Gerät zurechtkommen und er muss diese Therapie als positiv akzeptieren. Zudem müssen der Patient bzw. die betreuenden Angehörigen die hygienischen Vorgaben zum Gerätebetrieb kennen. Ferner muss die Therapieindikation sowie die Kontrolle der Anwendung (z. B. mittels Auslesen der Gerätebetriebsstunden), immer wieder ambulant überprüft und dokumentiert werden, was auch von den Kostenträgern gefordert wird.
Autor:
Prof. Dr. med. Dr. rer. medic. Adrian Gillissen, Kreiskliniken Am Steinenberg,
Med. Klinik III, Am Steinenberg 31, 72764 Reutlingen
_______
1 Rochwerg B, Brochard L, Elliott MW et al. Official ERS/ATS clinical practice guidelines: noninvasive ventilation for acute respiratory failure. Eur Respir J 2017; 50: 1602426
2 Ergan B, Oczkowski S, Rochwerg B et al. European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J 2019; 54: 1901003
3 Westhoff M, Neumann P, Geiseler J et al. 10 Kernaussagen zur S2k-Leitlinie „Nichtinvasive Beatmung als Therapie der akuten respiratorischen Insuffizienz“. Med Klin
Intensivmed Notfmed 2023; 1–4
4 Lacasse Y, Casaburi R, Sliwinski P et al. Home oxygen for moderate hypoxaemia in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Lancet Respir Med 2022; 10: 1029–37
5 Gillissen A. Das Wichtigste zur O2-Gabe bei respiratorischer Insuffizienz. MMW Fortschr Med 2018; 160: 51–55
6 Raveling T, Vonk J, Struik FM et al. Chronic non-invasive ventilation for chronic
obstructive pulmonary disease. Cochrane Database Syst Rev 2021; 8: CD002878
7 Köhnlein T, Windisch W, Köhler D et al. Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease: a prospective, multicentre, randomised, controlled clinical trial. Lancet Respir Med 2014; 2: 698–705
8 Osadnik CR, Tee VS, Carson-Chahhoud KV et al. Non-invasive ventilation for the
management of acute hypercapnic respiratory failure due to exacerbation of chronic
obstructive pulmonary disease. Cochrane Database Syst Rev 2017; 7: CD004104
9 Davidson AC, Banham S, Elliott M et al. BTS/ICS guideline for the ventilatory management of acute hypercapnic respiratory failure in adults. Thorax 2016; 71(Suppl 2): ii1–35